Precisa de Ajuda Regulatória? Experimente Nossa Plataforma
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
23 de junho de 2025
Aproximadamente 5 minutos
Resumo da Documentação Técnica (STED) para Dispositivos Médicos em Hong Kong: Um Guia para TR-002
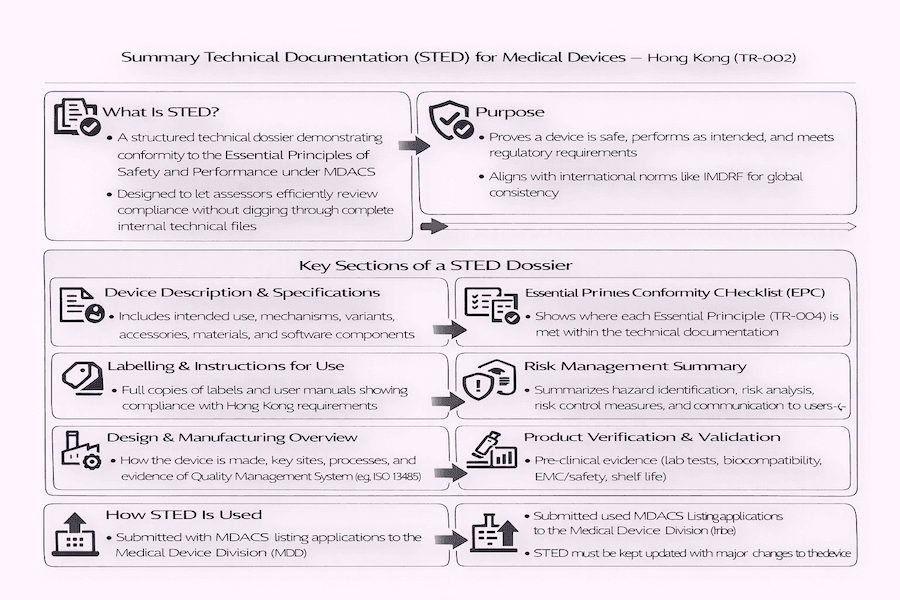
O Papel da Documentação Técnica Resumida (STED) no MDACS de Hong Kong: Nossa Perspectiva
No Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) de Hong Kong, demonstrar que seu dispositivo médico é seguro e funciona como deveria é um requisito fundamental para sua listagem. Para nossa compreensão, uma das principais maneiras que fabricantes e Pessoas Responsáveis Locais (LRPs) provam isso é através da Documentação Técnica Resumida (STED). A Referência Técnica TR-002, intitulada "Documentação Técnica Resumida para Demonstrar Conformidade com os Princípios Essenciais de Segurança e Desempenho de Dispositivos Médicos", fornece orientações muito detalhadas sobre exatamente o que deve estar neste documento crucial e como ele deve ser organizado. Isso é vital para documentação de dispositivos médicos em Hong Kong. De acordo com nossa experiência, a estrutura do STED é projetada para alinhar-se com diretrizes internacionais, especialmente aquelas do Fórum Internacional de Reguladores de Dispositivos Médicos (IMDRF). Isso ajuda a manter as coisas consistentes globalmente ao enviar sua documentação regulatória.
Qual é a Grande Ideia por Trás do STED? Seu Propósito Explicado
Então, por que precisamos do STED? Pense no STED como uma coleção de informações bem organizada e abrangente. Sua função é mostrar objetivamente que um dispositivo médico realmente atende aos Princípios Essenciais de Segurança e Desempenho (que estão detalhados no TR-004). De nossa perspectiva, isso permite que a Divisão de Dispositivos Médicos (MDD) verifique rápida e eficientemente se um dispositivo está em conformidade, sem precisar vasculhar um enorme arquivo técnico detalhado imediatamente. Mas não nos entenda mal, ainda fornece detalhes suficientes para uma revisão completa. O que torna um STED mais extenso? A quantidade de evidências necessárias no STED definitivamente aumenta com a classe de risco do dispositivo médico, quão complexo ele é e se utiliza nova tecnologia. Isso impacta diretamente a registro de dispositivos médicos em Hong Kong.
Seções Chave de um Dossiê STED: O Que Deve Estar Dentro?
O TR-002 descreve claramente as seções obrigatórias que um dossiê STED deve conter para mostrar adequadamente que seu dispositivo está em conformidade com as regras. Com base em nossa experiência, essas seções geralmente incluem:
- Descrição e Especificação do Dispositivo (Incluindo Variantes e Acessórios): O Que é Seu Dispositivo?
- Você precisa de uma descrição clara e breve do seu dispositivo, para que ele serve (sua finalidade pretendida), quais condições ele é usado para tratar ou diagnosticar e como ele realmente funciona.
- Informações sobre diferentes versões (variantes) do seu dispositivo, quaisquer acessórios e como eles se relacionam com o dispositivo principal.
- Detalhes sobre os materiais que você usou, como ele opera e quaisquer partes de software.
- Rotulagem e Instruções de Uso (IFU): Como as Pessoas Usarão Isso com Segurança?
- Cópias de toda a sua rotulagem, incluindo rótulos de embalagem, marcações no próprio dispositivo e as Instruções de Uso (IFU) completas.
- Crucialmente, deve estar claro que você atende aos requisitos específicos de rotulagem de Hong Kong (como o TR-005, que fala sobre a necessidade de conteúdo em inglês e chinês, o número HKMD e informações do LRP). Isso ajuda a garantir a conformidade de dispositivos médicos em Hong Kong.
- Informações de Design e Fabricação: Como Foi Feito?
- Uma visão geral de como você fabrica o dispositivo.
- Detalhes sobre locais e processos de fabricação importantes.
- Prova de que você possui um forte Sistema de Gestão da Qualidade (QMS) em vigor, geralmente demonstrado por uma certificação ISO 13485 ou algo semelhante.
- Lista de Verificação dos Princípios Essenciais (EPC): Marcando Todas as Caixas
- Esta é uma lista de verificação que identifica todos os Princípios Essenciais que se aplicam ao seu dispositivo específico.
- Para cada princípio, seu STED deve apontar para as seções exatas na sua documentação técnica onde você demonstrou conformidade. De acordo com nossa experiência, isso atua como um mapa claro para o avaliador da MDD, facilitando muito seu trabalho.
- Gestão de Riscos: Identificando e Controlando Perigos
- Um resumo do seu plano para gerenciar riscos e os resultados da sua análise de riscos (por exemplo, seguindo os padrões ISO 14971).
- Evidências de que você identificou todos os riscos, avaliou-os e os reduziu o máximo possível de forma razoável.
- Informações sobre quaisquer riscos que não puderam ser completamente eliminados e como você informa os usuários sobre eles.
- Verificação e Validação do Produto: Provando que Funciona
- Dados Pré-clínicos: Resumos de testes laboratoriais, estudos sobre como interage com materiais biológicos (biocompatibilidade), segurança elétrica, compatibilidade eletromagnética (EMC), verificações de software, verificações de esterilização e estudos de vida útil.
- Dados Clínicos: Resumos de como o dispositivo se comportou em ambientes clínicos reais, quaisquer investigações ou ensaios clínicos que você tenha realizado (se aplicável) e dados do monitoramento após a venda. Para nossa compreensão, o tipo e a quantidade de evidência clínica necessária dependem fortemente do quão arriscado e novo seu dispositivo é.
- Avaliação de Desempenho (apenas para IVDMDs): Dados específicos mostrando quão bem os dispositivos médicos de diagnóstico in vitro se desempenham analiticamente e clinicamente.
Preparando o Dossiê STED: Nosso Conselho Prático
Os fabricantes, geralmente trabalhando em conjunto com seu LRP, são responsáveis por montar o dossiê STED. Quais são algumas coisas-chave que sempre dizemos aos nossos clientes para manter em mente durante essa preparação?
- Clareza e Concisão: Embora precise ser abrangente, o STED deve ser bem organizado e fácil para alguém ler e entender rapidamente.
- Rastreabilidade: Certifique-se de que haja conexões claras entre cada Princípio Essencial e os documentos técnicos específicos que o apoiam.
- Precisão: Todas as informações que você fornecer devem ser precisas e refletir o status atual do seu dispositivo.
- Idioma: A documentação deve estar em inglês e, para algumas partes, pode também precisar estar em chinês, conforme especificado pelas diretrizes do MDACS. De acordo com nossa experiência, o STED não é um documento único; é um documento vivo. Quaisquer mudanças significativas no seu dispositivo (como explicado no GN-10) exigirão que você atualize seu dossiê STED para manter a validade da listagem do seu dispositivo. Submeter com sucesso um STED bem preparado é um passo crucial para colocar seus dispositivos médicos no mercado de Hong Kong.
Pergunte Qualquer Coisa
Entraremos em contato pessoalmente.
Precisa de Orientação Especializada?
Explore Nosso Guia Interativo de Dispositivos Médicos
Obtenha orientação passo a passo sobre as regulamentações de dispositivos médicos de Hong Kong, classificação de dispositivos e requisitos de conformidade.
Ver Guia de Dispositivos MédicosEntre em contato conosco em contact@elendilabs.com / +852 4416 5550
Artigos Relacionados
Aproximadamente 5 minutos
Relato de Eventos Adversos de Dispositivos Médicos em Hong Kong: Um Guia para LRPs
A notificação de eventos adversos é um componente crítico do Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), com o objetivo de melhorar a saúde e a segurança pública. Este artigo descreve os requisitos e responsabilidades das Pessoas Responsáveis Locais (LRPs) na notificação de eventos adversos relacionados a dispositivos médicos listados, com base em nossas percepções.
Aproximadamente 5 minutos
Regulamentações e Registro de Dispositivos Médicos em Hong Kong
Guia completo sobre regulamentações de dispositivos médicos, classificação, requisitos de registro e vigilância pós-comercialização em Hong Kong.
Aproximadamente 5 minutos
Navegando nas Regulamentações de Dispositivos Médicos em Hong Kong: A Estrutura MDACS
O Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) de Hong Kong fornece uma estrutura robusta, embora atualmente voluntária, para a regulamentação de dispositivos médicos. Este artigo explora as principais características do sistema, incluindo a classificação de dispositivos, o processo de listagem, o papel crucial das Pessoas Responsáveis Locais (LRPs) e sua importância crescente para o acesso ao mercado e a aquisição pública, tudo a partir de nossas percepções e experiências.
Aproximadamente 5 minutos
Procedimentos de Listagem para Fabricantes Locais de Dispositivos Médicos em Hong Kong: Um Guia para GN-08
Este artigo detalha o processo de aplicação para fabricantes locais de dispositivos médicos que buscam ser listados sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme orientado pelo GN-08. Ele abrange elegibilidade, requisitos do sistema de gestão da qualidade e o processo de submissão, tudo baseado em nossas percepções e experiências para uma fabricação eficaz de dispositivos médicos em Hong Kong.
Aproximadamente 5 minutos
Procedimentos de Listagem para Importadores de Dispositivos Médicos em Hong Kong: Um Guia para GN-07
Para entidades que importam dispositivos médicos para Hong Kong, o Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) oferece um esquema de listagem voluntária para importadores, orientado pela GN-07. Este artigo detalha a elegibilidade, os passos de aplicação e os principais requisitos para a listagem como importador de dispositivos médicos, com base em nossas percepções e experiências para uma importação eficiente de dispositivos médicos em Hong Kong.
Aproximadamente 5 minutos
Procedimentos de Listagem para Distribuidores de Dispositivos Médicos em Hong Kong: Um Guia para GN-09
Este artigo descreve o processo de aplicação para distribuidores de dispositivos médicos que buscam ser listados sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme detalhado no GN-09. Ele abrange elegibilidade, requisitos-chave para procedimentos documentados e o processo de submissão para aprimorar a rastreabilidade e a segurança pública, com base em nossas percepções.
Aproximadamente 5 minutos
Procedimentos de Listagem para Dispositivos Médicos de Diagnóstico In Vitro de Classe B, C e D em Hong Kong: Um Guia para GN-06
Este artigo detalha o processo de aplicação para listar Dispositivos Médicos de Diagnóstico In Vitro de Classe B, C e D (IVDMDs) sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme orientado pelo GN-06. Ele abrange classificação, elegibilidade, requisitos de submissão e a aplicação online via MDIS, tudo baseado em nossos insights e experiência para uma listagem eficiente de IVDMD em Hong Kong.