Precisa de Ajuda Regulatória? Experimente Nossa Plataforma
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
16 de dezembro de 2025
Aproximadamente 5 minutos
Regulamentação SaMD de Singapura: Cibersegurança, IA e Conformidade do Ciclo de Vida
Regulamentação SaMD de Singapura: Cibersegurança, IA e Conformidade do Ciclo de Vida
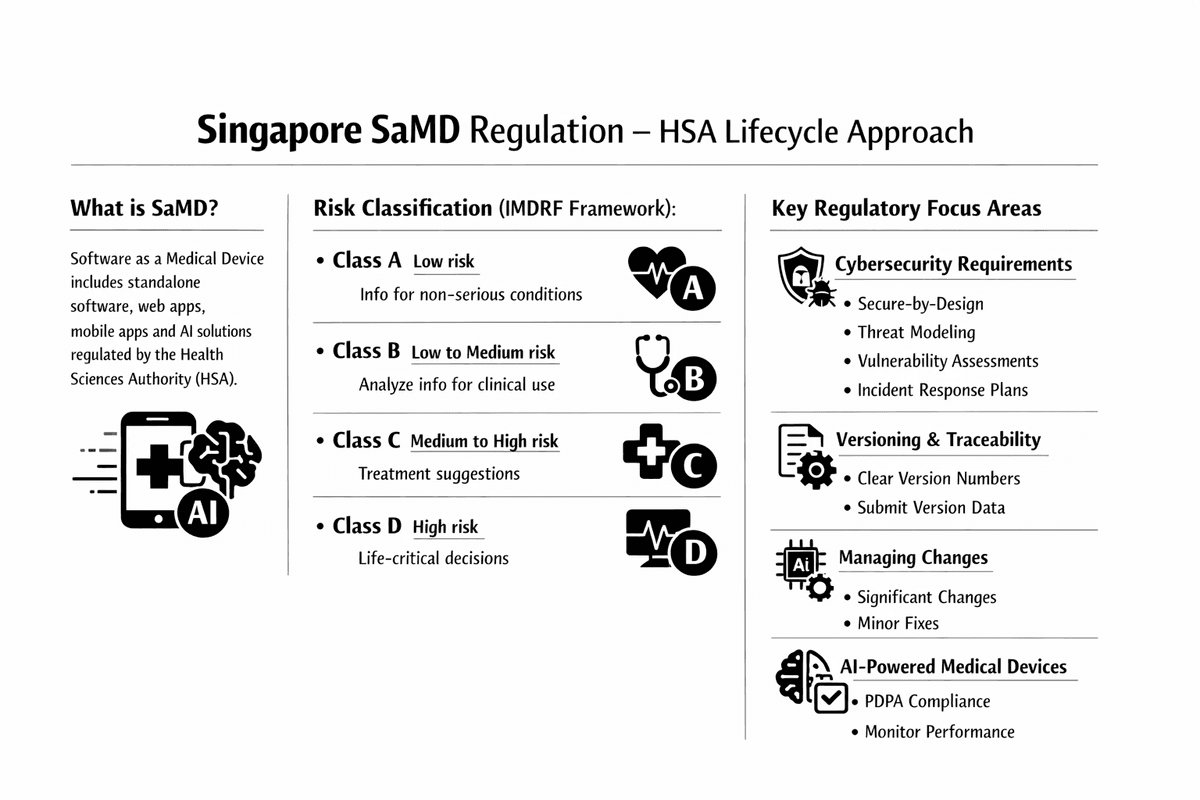
O Software como Dispositivo Médico (SaMD), que inclui software autônomo, aplicativos baseados na web, aplicativos móveis e soluções de Inteligência Artificial (IA), é regulamentado de forma abrangente pela Health Sciences Authority (HSA) em Singapura. A HSA emprega uma abordagem de ciclo de vida, delineada em suas Diretrizes Regulatórias para Dispositivos Médicos de Software, cobrindo desenvolvimento, registro e obrigações pós-mercado.
Classificação e Registro
A HSA segue a estrutura do Fórum Internacional de Reguladores de Dispositivos Médicos (IMDRF) para classificar o SaMD, que se baseia na importância da informação fornecida pelo software e no estado da situação ou condição de saúde. O SaMD é categorizado em quatro classes de risco (A, B, C, D).
| Classificação SaMD (IMDRF) | Nível de Risco | Funções Exemplo de SaMD |
|---|---|---|
| Classe A | Risco Baixo | Fornece informações que orientam o gerenciamento clínico, mas para condições não sérias (por exemplo, aplicativo de educação do paciente). |
| Classe B | Risco Baixo a Médio | Processa, analisa ou cria informações para gerenciamento clínico em condições não sérias (por exemplo, visualização básica de imagem de diagnóstico). |
| Classe C | Risco Médio a Alto | Processa ou analisa informações para gerenciamento clínico em condições sérias (por exemplo, software que sugere opções de tratamento para câncer). |
| Classe D | Risco Alto | Fornece informações críticas para gerenciamento clínico em condições ou estados críticos (por exemplo, software que monitora dados do paciente para recomendar intervenção imediata de salvamento). |
Todos os SaMD registráveis devem passar pelo processo padrão de registro de produto, aderindo aos requisitos da classe de risco determinada.
Áreas Focais Regulatórias Chave para SaMD
1. Requisitos de Cibersegurança
A HSA coloca uma grande ênfase na gestão de riscos de cibersegurança ao longo do ciclo de vida do SaMD. Os dossiês de registro devem ser apoiados por uma estratégia de cibersegurança documentada, incluindo:
- Arquitetura 'Segura por Design': Integração de medidas de segurança desde a fase inicial de desenvolvimento.
- Modelagem de Ameaças: Identificação e avaliação sistemática de vulnerabilidades potenciais.
- Avaliações de Vulnerabilidade: Testes contínuos para detectar e mitigar riscos.
- Planos de Resposta a Incidentes: Planos detalhados para detecção e resposta a ameaças em tempo real na fase pós-mercado.
2. Versionamento e Rastreabilidade
O versionamento de software claro e consistente é obrigatório para a identificação adequada e rastreabilidade pós-mercado. Os requisitos de rotulagem para SaMD (GN-23) especificam que:
- O número da versão do software deve ser exibido claramente (por exemplo, na tela inicial ou interface do usuário para aplicativos baixados ou baseados na web).
- Os dados de versionamento devem ser submetidos como parte do dossiê de registro e devem refletir mudanças na funcionalidade, interface do usuário ou correções de bugs.
3. Gerenciamento de Mudanças (Notificações de Mudança)
Qualquer mudança em um SaMD registrado requer uma Notificação de Mudança para a HSA. As mudanças são classificadas com base em seu impacto:
- Mudanças Significativas: Exigem uma revisão técnica mais rigorosa e incluem grandes modificações de algoritmo, introdução de novos recursos de IA ou redesenhos de interface que afetam a usabilidade ou segurança.
- Mudanças Não-Significativas: Tipicamente correções administrativas ou de bugs menores que não afetam o uso pretendido ou o perfil de risco.
4. Dispositivos Médicos Alimentados por IA (AI-MD)
Os SaMDs baseados em IA devem cumprir todos os regulamentos de dispositivos médicos e leis específicas de privacidade de dados em Singapura, como a Lei de Proteção de Dados Pessoais (PDPA). A orientação da HSA (GL7) descreve os princípios para fabricantes que implementam algoritmos adaptativos ou de aprendizado contínuo, enfatizando:
- Abordar as implicações regulatórias de modelos de aprendizado contínuo e retreinamento de modelos.
- Garantir o monitoramento contínuo do desempenho e a coleta de evidências do mundo real.
- Notificação periódica à HSA sobre o desempenho do modelo de IA.
Pergunte Qualquer Coisa
Entraremos em contato pessoalmente.
Precisa de Orientação Especializada?
Entre em contato conosco em contact@elendilabs.com / +852 4416 5550
Artigos Relacionados
Aproximadamente 5 minutos
Registro de Dispositivos Médicos em Singapura: O Sistema de Confiança Multivias da HSA
A HSA de Singapura regulamenta o registro de dispositivos médicos usando uma classificação baseada em risco (Classe A-D) e quatro vias de confiança: Imediata, Expedida, Abreviada e Completa. O registro exige um **Registrante** local e é facilitado por aprovações em **Países de Referência** para otimizar o processo e reduzir os prazos de revisão de 310 dias (Completo) para imediato.
Aproximadamente 5 minutos
Registro de Dispositivos IVD em Singapura: Vias de Confiança Baseadas em Risco da HSA
A HSA regulamenta dispositivos IVD em Singapura com base na classificação de risco GHTF (A-D). O registro aproveita aprovações de **Países de Referência** para determinar a via (Imediata, Expedida, Abreviada ou Completa), reduzindo significativamente os tempos de revisão, que podem variar de **0 dias úteis** (Imediata) a **310 dias úteis** (Completa para Classe D). Todos os pedidos devem ser submetidos por um **Registrante** local.
Aproximadamente 5 minutos
Classificação de Dispositivos Médicos em Singapura: Uma Abordagem GHTF Baseada em Risco
A Health Sciences Authority (HSA) de Singapura classifica dispositivos médicos (MD) e IVDs em quatro classes de risco (**Classe A, B, C, D**) seguindo a **orientação GHTF**. O risco é determinado por fatores como uso pretendido, invasividade e duração do contato. Dispositivos de risco mais alto exigem registro mais rigoroso. Regras especiais se aplicam a **Software como Dispositivo Médico (SaMD)** e dispositivos para telesaúde ou fins estéticos.
Aproximadamente 5 minutos
Agrupamento de Dispositivos Médicos para Registro em Singapura: Vias de Economia de Custos da HSA
A HSA de Singapura permite que fabricantes de dispositivos médicos e IVD consolidem múltiplos produtos em um único pedido de registro através de vários mecanismos de agrupamento, como **Família**, **Sistema** e **Grupo**. Esta abordagem reduz custos e tempo de processamento, desde que os dispositivos compartilhem critérios como uso pretendido, classe de risco e design. Regras específicas existem para analisadores IVD, kits de teste e dispositivos odontológicos.
Aproximadamente 5 minutos
GDPMDS de Singapura: O SGQ Obrigatório para a Distribuição de Dispositivos Médicos
O **Good Distribution Practice for Medical Devices (GDPMDS)**, formalizado sob a SS 620:2016, é um padrão obrigatório de Sistema de Gestão de Qualidade (SGQ) em Singapura. É aplicado pela **HSA** e exigido para todas as empresas envolvidas na **importação e distribuição por atacado** de dispositivos médicos e IVDs. A certificação GDPMDS é o passo fundamental para a obtenção de uma Licença de Revendedor de Dispositivos Médicos.
Aproximadamente 5 minutos
Rotulagem de Dispositivos Médicos em Singapura: Conformidade com HSA e Harmonização AMDD
A HSA de Singapura exige que a rotulagem de dispositivos médicos e IVDs esteja em **Inglês** e se harmonize com a **Diretiva de Dispositivos Médicos da ASEAN (AMDD)**, detalhada na **Orientação GN-23**. A etiqueta deve conter informações para identificação e uso seguro, incluindo detalhes do proprietário do produto, número de lote/lote e status de esterilização. Os IVDs têm requisitos adicionais que cobrem o uso pretendido, características de desempenho e tipo de amostra.
Aproximadamente 5 minutos
Manutenção da Licença de Dispositivos Médicos em Singapura: Taxas Anuais e Notificações de Mudança
Manter um registro de dispositivo médico em Singapura exige o pagamento de uma **Taxa Anual de Retenção** e a notificação obrigatória de todas as mudanças através de **Modificação de Registro (Notificações de Mudança)** à HSA. As mudanças são categorizadas como Administrativas, de Revisão ou Técnicas, com tempos de processamento que variam de **30 a 90 dias**, dependendo da classe do dispositivo e da natureza da mudança. Mudanças importantes, como uma mudança no uso pretendido, exigem um **novo registro de produto**.
Aproximadamente 5 minutos
Vigilância Pós-Mercado em Singapura: Relatório Obrigatório de Eventos Adversos à HSA
A HSA de Singapura exige vigilância pós-mercado para todos os dispositivos médicos sob a Lei de Produtos de Saúde. O **Registrante/Distribuidor** local é o principal responsável por relatar Eventos Adversos (AEs) ocorridos em Singapura, que devem ser notificados em prazos que variam de **48 horas (ameaça à saúde pública)** a **30 dias (potencial lesão grave em caso de recorrência)**, dependendo da gravidade. Os fabricantes são responsáveis por fornecer todas as informações necessárias, com o prazo começando imediatamente após a notificação do evento.