Precisa de Ajuda Regulatória? Experimente Nossa Plataforma
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
20 de março de 2024
Aproximadamente 5 minutos
Registro de Produtos Farmacêuticos Contendo uma Nova Entidade Química ou Biológica em Hong Kong
Registro de Produtos Farmacêuticos Contendo uma Nova Entidade Química ou Biológica em Hong Kong
O registro de produtos farmacêuticos contendo novas entidades químicas ou biológicas (NCEs/NBEs) em Hong Kong segue um rigoroso quadro regulatório para garantir a saúde e segurança pública. Este guia fornece informações abrangentes sobre o processo de registro e requisitos.
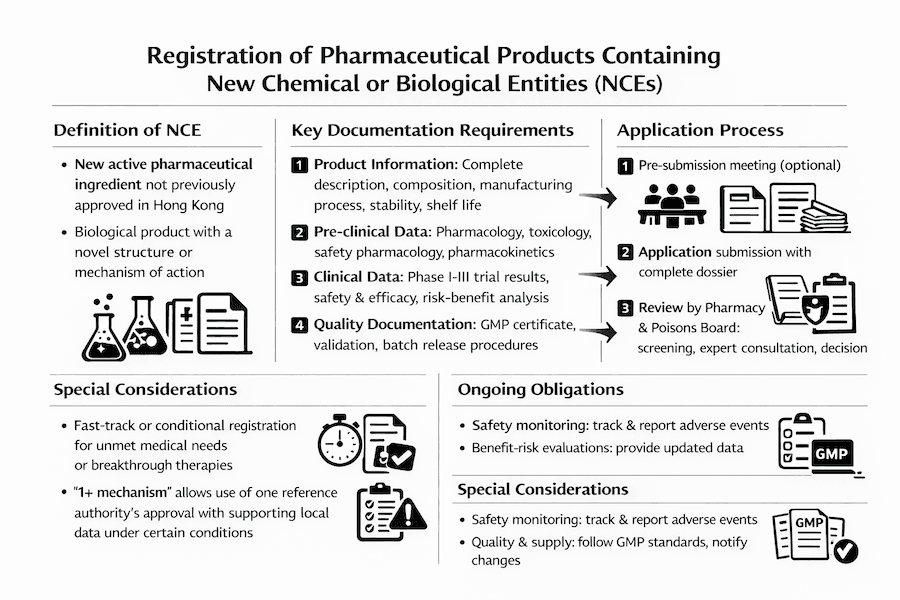
Definição de Nova Entidade Química ou Biológica
Uma nova entidade química ou biológica é definida como:
- Um novo ingrediente farmacêutico ativo (API) que não foi previamente aprovado em Hong Kong
- Uma substância que não foi previamente registrada como um produto farmacêutico
- Um produto biológico com uma nova estrutura molecular ou mecanismo de ação
Requisitos de Registro
Requisitos de Documentação
1. Informações do Produto
- Descrição completa do produto
- Composição detalhada
- Processo de fabricação
- Procedimentos de controle de qualidade
- Dados de estabilidade
- Informações sobre vida útil
2. Dados Pré-clínicos
- Estudos farmacológicos
- Estudos toxicológicos
- Farmacologia de segurança
- Dados farmacocinéticos
3. Dados Clínicos
- Resultados de ensaios clínicos de Fase I, II e III
- Dados de segurança e eficácia
- Análise de risco-benefício
- Plano de vigilância pós-comercialização
4. Documentação de Qualidade
- Licença de fabricação
- Certificado de conformidade com GMP
- Especificações de controle de qualidade
- Protocolos de validação
- Procedimentos de liberação de lote
Processo de Aplicação
-
Reunião Pré-submissão
- Reunião opcional com o Conselho de Farmácia e Venenos
- Discussão da estratégia de aplicação
- Esclarecimento de requisitos
-
Submissão da Aplicação
- Formulário de aplicação completo
- Toda a documentação necessária
- Pagamento da taxa de aplicação
-
Processo de Revisão
- Triagem inicial
- Revisão técnica
- Consulta a especialistas
- Tomada de decisão
-
Requisitos Pós-aprovação
- Atualizações regulares de segurança
- Avaliação periódica de benefício-risco
- Vigilância pós-comercialização
- Relato de eventos adversos
Considerações Especiais
Registro Acelerado
Produtos podem se qualificar para registro acelerado se:
- Atenderem a necessidades médicas não atendidas
- Apresentarem vantagens terapêuticas significativas
- Tratam condições graves ou ameaçadoras à vida
Registro Condicional
Em certos casos, o registro condicional pode ser concedido com:
- Compromissos específicos pós-comercialização
- Requisitos adicionais de monitoramento de segurança
- Período de aprovação inicial limitado
Conformidade Regulatória
Obrigações Contínuas
- Atualizações regulares de segurança
- Monitoramento de controle de qualidade
- Relato de eventos adversos
- Atualizações de rotulagem
- Notificação de mudanças na fabricação
Vigilância Pós-comercialização
- Sistema de farmacovigilância
- Plano de gerenciamento de risco
- Relatórios periódicos de atualização de segurança
- Detecção e gerenciamento de sinais
Melhores Práticas
Para Candidatos
-
Planejamento Antecipado
- Começar a preparação cedo
- Identificar todos os requisitos
- Planejar possíveis atrasos
-
Documentação
- Manter registros completos
- Garantir a integridade dos dados
- Seguir diretrizes de formatação
-
Comunicação
- Atualizações regulares às autoridades
- Resposta rápida a consultas
- Documentação clara
Para Profissionais de Saúde
-
Considerações de Prescrição
- Revisar dados de segurança
- Monitorar a resposta do paciente
- Relatar eventos adversos
-
Educação do Paciente
- Explicar benefícios e riscos
- Fornecer instruções de uso
- Monitorar a conformidade
Informações de Contato
Para mais informações ou assistência:
-
Conselho de Farmácia e Venenos
- Site: www.ppbhk.org.hk
-
Escritório de Medicamentos, Departamento de Saúde
- Site: www.drugoffice.gov.hk
Pergunte Qualquer Coisa
Entraremos em contato pessoalmente.
Precisa de Orientação Especializada?
Entre em contato conosco em contact@elendilabs.com / +852 4416 5550