Precisa de Ajuda Regulatória? Experimente Nossa Plataforma
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
20 de fevereiro de 2024
Aproximadamente 5 minutos
Registro de Produtos Biossimilares em Hong Kong: Um Guia Abrangente
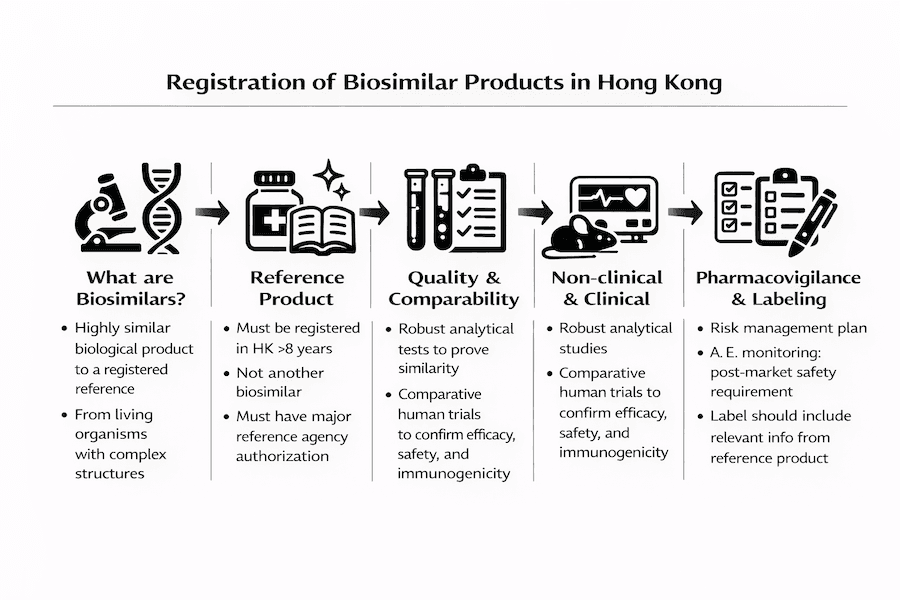
Registro de Produtos Biossimilares em Hong Kong: Um Guia Abrangente
Produtos biossimilares representam um avanço significativo na saúde, oferecendo alternativas mais acessíveis a medicamentos biológicos originais. Este guia fornece informações abrangentes sobre o processo de registro de produtos biossimilares em Hong Kong.
O que são Produtos Biossimilares?
Produtos biossimilares são medicamentos biológicos que são:
- Altamente semelhantes a um produto biológico já registrado (produto de referência)
- Derivados de organismos vivos
- Possuem estruturas moleculares complexas
- Requerem considerações especiais de qualidade devido à sua natureza biológica
Principais Requisitos de Registro
Requisitos do Produto de Referência
-
Elegibilidade do Produto de Referência
- Deve estar registrado em Hong Kong por mais de 8 anos
- Não pode ser outro produto biossimilar
- Deve ter autorização de comercialização de agências de referência reconhecidas
-
Agências de Referência Reconhecidas
- Administração de Alimentos e Medicamentos dos EUA (FDA)
- Agência Europeia de Medicamentos (EMA)
- Ministério da Saúde, Trabalho e Bem-Estar do Japão
- Administração de Bens Terapêuticos da Austrália
- Saúde Canadá
Requisitos de Qualidade
-
Caracterização Abrangente
- Caracterização extensa da substância ativa
- Análise detalhada do produto acabado
- Documentação completa do processo de fabricação
- Procedimentos de controle de qualidade
-
Exercício de Comparabilidade
- Comparação direta com o produto de referência
- Análise detalhada dos atributos de qualidade
- Justificativa para quaisquer diferenças observadas
- Avaliação do impacto na segurança e eficácia
Requisitos Não Clínicos
-
Estudos Necessários
- Estudos in vitro (por exemplo, estudos de ligação a receptores)
- Estudos in vivo quando necessário
- Estudos de toxicidade de doses repetidas
- Medições toxicocinéticas
-
Desenho do Estudo
- Comparativo por natureza
- Projetado para detectar diferenças
- Foco na atividade biológica
- Relevante para a aplicação clínica
Requisitos Clínicos
-
Estudos Necessários
- Estudos de farmacocinética (PK)
- Estudos de farmacodinâmica (PD)
- Ensaios de eficácia e segurança clínica
- Estudos de imunogenicidade
-
População do Estudo
- Sensível para detectar diferenças
- Apropriada para a indicação
- Representativa da população-alvo
-
Extrapolação de Dados
- Justificativa científica necessária
- Consideração da imunogenicidade
- Avaliação de riscos específicos da indicação
Considerações Especiais
Estudos de Imunogenicidade
-
Componentes Necessários
- Estratégia de teste de anticorpos
- Caracterização da resposta imune
- Avaliação do impacto dos anticorpos
- Avaliação de risco para diferentes indicações
-
Desenho do Estudo
- Abordagem comparativa
- Foco em população de alto risco
- Monitoramento a longo prazo
- Avaliação de segurança
Requisitos de Farmacovigilância
-
Monitoramento Pós-Comercialização
- PSURs semestrais nos primeiros 2 anos
- PSURs anuais nos próximos 3 anos
- Relato de reações adversas
- Plano de gerenciamento de riscos
-
Gerenciamento de Riscos
- Materiais educativos para profissionais de saúde
- Materiais de informação para pacientes
- Estratégias de mitigação de riscos
- Vigilância pós-comercialização
Requisitos de Rotulagem
-
Informações Obrigatórias
- Declaração do produto biossimilar
- Detalhes do produto e do fabricante
- Indicações registradas
- Informações sobre estudos clínicos
- Aviso de substituição
-
Alegações Proibidas
- Nenhuma alegação de bioequivalência
- Nenhuma alegação de equivalência clínica
- Nenhuma alegação de substituição automática
Melhores Práticas
Para Candidatos
-
Preparação
- Planejamento antecipado
- Documentação completa
- Abordagem focada na qualidade
- Avaliação de riscos
-
Documentação
- Dossiê de qualidade abrangente
- Dados de comparabilidade detalhados
- Justificativa clara para diferenças
- Dados clínicos completos
Para Profissionais de Saúde
-
Considerações de Prescrição
- Revisão dos dados de segurança
- Monitoramento do paciente
- Relato de eventos adversos
- Avaliação de riscos
-
Educação do Paciente
- Informações sobre o produto
- Comunicação de riscos
- Orientações de monitoramento
- Instruções de relato
Informações de Contato
Para mais informações ou assistência:
-
Conselho de Farmácia e Poisons
- Website: www.ppbhk.org.hk
-
Escritório de Medicamentos, Departamento de Saúde
- Website: www.drugoffice.gov.hk
Pergunte Qualquer Coisa
Entraremos em contato pessoalmente.
Precisa de Orientação Especializada?
Entre em contato conosco em contact@elendilabs.com / +852 4416 5550