Precisa de Ajuda Regulatória? Experimente Nossa Plataforma
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
10 de maio de 2024
Aproximadamente 5 minutos
Registro de Produtos de Terapia Avançada em Hong Kong: Um Guia Abrangente
Registro de Produtos de Terapia Avançada em Hong Kong: Um Guia Abrangente
Produtos de Terapia Avançada (PTAs) representam a vanguarda da inovação médica, oferecendo novas possibilidades de tratamento para várias condições. Este guia fornece informações abrangentes sobre o processo de registro de PTAs em Hong Kong.
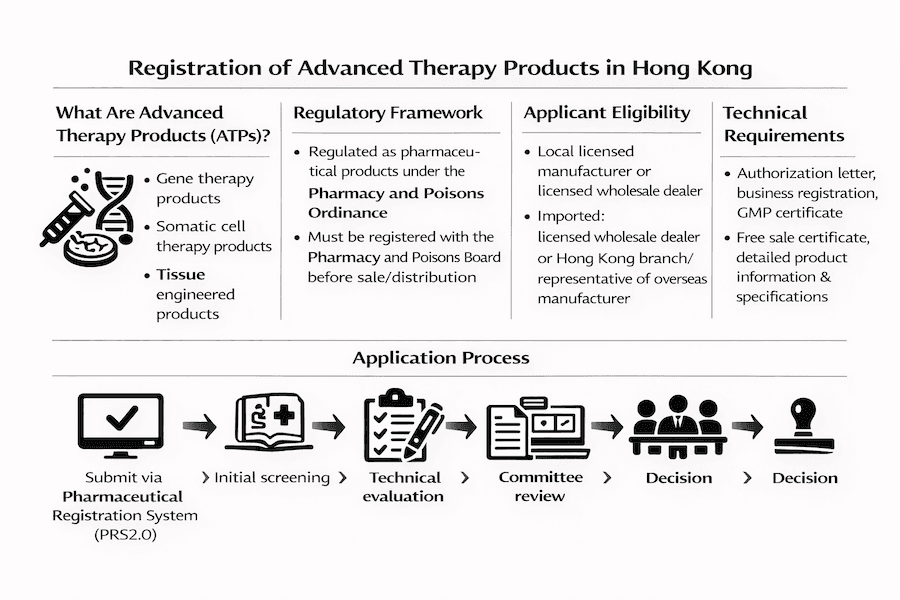
O que são Produtos de Terapia Avançada?
PTAs são produtos farmacêuticos para uso humano que incluem:
-
Produtos de Terapia Gênica
- Produtos contendo sequências de ácidos nucleicos recombinantes
- Usados para regular, reparar, substituir, adicionar ou deletar sequências genéticas
- Administrados a humanos para fins terapêuticos
-
Produtos de Terapia com Células Somáticas
- Produtos contendo células ou tecidos
- Manipulados para alterar suas características biológicas
- Usados para fins terapêuticos
-
Produtos de Engenharia de Tecidos
- Produtos contendo células ou tecidos
- Modificados para reparar, regenerar ou substituir tecido humano
- Podem conter células viáveis ou não viáveis
Requisitos de Registro
Requisitos Básicos
-
Estrutura Legal
- Regulamentado pela Lei de Farmácia e Venenos (Cap. 138)
- Deve atender a critérios de segurança, eficácia e qualidade
- Requer Certificado de Registro de Medicamento/Produto
-
Elegibilidade do Solicitante
- Para produtos fabricados em Hong Kong:
- Fabricante licenciado, ou
- Distribuidor atacadista licenciado contratando com o fabricante
- Para produtos importados:
- Distribuidor atacadista licenciado, ou
- Filial/representante de Hong Kong de fabricante estrangeiro
- Para produtos fabricados em Hong Kong:
Requisitos de Documentação
-
Documentos Essenciais
- Carta de autorização do fabricante estrangeiro (se aplicável)
- Certificado de registro comercial
- Licença do fabricante
- Certificado de GMP
- Certificado de venda livre
- Aprovações de registro de países de referência
-
Informações do Produto
- Pacote de vendas do protótipo
- Folheto informativo
- Informações de rotulagem
- Especificações do produto
- Detalhes de fabricação
Requisitos Técnicos
Requisitos de Qualidade (Módulo 3)
-
Processo de Fabricação
- Descrição detalhada do processo
- Procedimentos de controle de qualidade
- Protocolos de validação
- Dados de estabilidade
-
Caracterização do Produto
- Propriedades físicas e químicas
- Atividade biológica
- Pureza e impurezas
- Especificações
Requisitos Não Clínicos (Módulo 4)
-
Estudos de Farmacologia
- Farmacodinâmica primária
- Farmacodinâmica secundária
- Farmacologia de segurança
-
Estudos de Toxicologia
- Toxicidade de dose única e repetida
- Genotoxicidade
- Carcinogenicidade
- Toxicidade reprodutiva
- Imunotoxicidade
Requisitos Clínicos (Módulo 5)
-
Desenvolvimento Clínico
- Ensaios clínicos de Fase I-III
- Dados de segurança e eficácia
- Acompanhamento a longo prazo
- Plano de gerenciamento de riscos
-
Considerações Especiais
- Procedimentos cirúrgicos
- Compatibilidade de dispositivos
- Treinamento de profissionais de saúde
- Mudanças no processo de fabricação
Requisitos Especiais por Tipo de Produto
Produtos de Terapia Gênica
-
Farmacocinética
- Estudos de eliminação
- Estudos de biodistribuição
- Estudos de expressão gênica
-
Estudos de Segurança
- Vetor competente para replicação
- Emergência de novas cepas
- Mutagenicidade de inserção
Produtos de Terapia com Células Somáticas
-
Biodistribuição
- Persistência celular
- Estudos de enxerto
- Efeitos a longo prazo
-
Avaliação de Segurança
- Padrões de distribuição
- Enxerto ectópico
- Transformação oncogênica
Produtos de Engenharia de Tecidos
-
Caracterização do Produto
- Persistência de componentes
- Estudos de degradação
- Evidências de regeneração
-
Avaliação de Segurança
- Padrões de distribuição
- Estudos de enxerto
- Fidelidade da linhagem de tecido
Processo de Aplicação
-
Submissão
- Utilize o Sistema de Registro Farmacêutico 2.0 (PRS2.0)
- Pague a taxa de inscrição (HK$1.100)
- Envie todos os documentos necessários
-
Processo de Revisão
- Triagem inicial
- Avaliação técnica
- Revisão do comitê
- Tomada de decisão
Requisitos Pós-Aprovação
-
Monitoramento
- Relato de eventos adversos
- Atualizações periódicas de segurança
- Acompanhamento a longo prazo
-
Conformidade
- Manutenção de GMP
- Controle de qualidade
- Atualizações de documentação
Informações de Contato
Para mais informações ou assistência:
-
Conselho de Farmácia e Venenos
- Site: www.ppbhk.org.hk
-
Escritório de Medicamentos, Departamento de Saúde
- Site: www.drugoffice.gov.hk
Pergunte Qualquer Coisa
Entraremos em contato pessoalmente.
Precisa de Orientação Especializada?
Entre em contato conosco em contact@elendilabs.com / +852 4416 5550