Precisa de Ajuda Regulatória? Experimente Nossa Plataforma
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
23 de junho de 2025
Aproximadamente 5 minutos
Registro de Dispositivos Médicos em Hong Kong: Requisitos e Procedimentos Essenciais
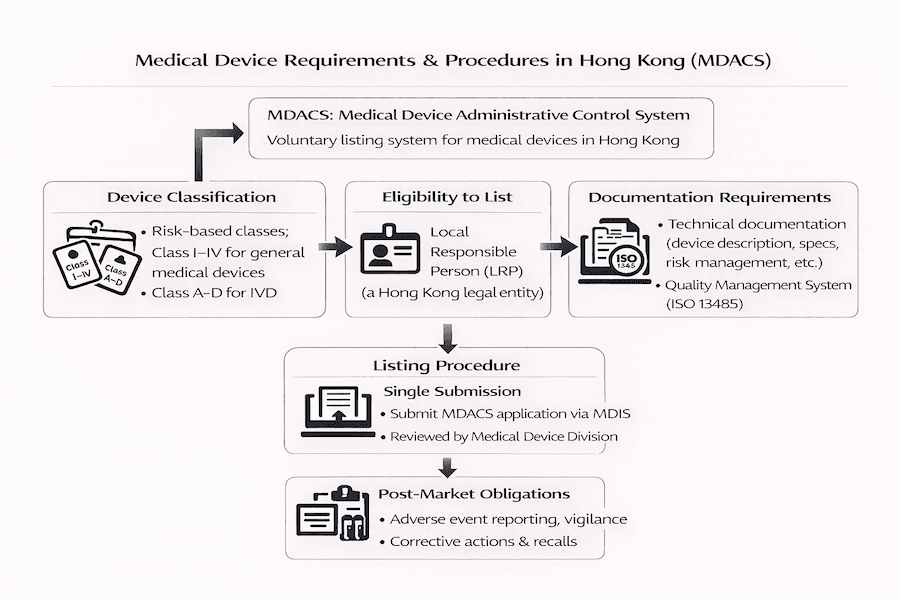
Registro de Dispositivos Médicos em Hong Kong: Requisitos e Procedimentos Essenciais – Nossas Perspectivas
Pelo que observamos, listar seu dispositivo médico em Hong Kong significa navegar pelo Sistema de Controle Administrativo de Dispositivos Médicos (MDACS). Este guia, baseado em nossa experiência, tem como objetivo fornecer uma visão clara, passo a passo, dos requisitos e procedimentos essenciais envolvidos. O foco é garantir que seu dispositivo esteja pronto para o mercado de saúde de Hong Kong.
Requisitos Essenciais: O Que Você Absolutamente Precisa?
Então, quais são as coisas fundamentais que você deve ter em mente? Vamos mergulhar:
1. Classificação do Dispositivo: Quão Arriscado É Seu Dispositivo?
Você já se perguntou como os dispositivos médicos são categorizados em Hong Kong? De acordo com nossa compreensão, o MDACS utiliza um sistema baseado em risco, colocando os dispositivos em quatro classes principais:
- Classe I (Dispositivos de baixo risco): Pense em itens simples do dia a dia, como bandagens não medicadas ou muletas.
- Classe II (Dispositivos de risco médio): Incluem coisas como agulhas hipodérmicas ou termômetros eletrônicos.
- Classe III (Dispositivos de alto risco): Mais complexos, como ventiladores pulmonares ou lentes de contato.
- Classe IV (Dispositivos de risco mais alto): Itens críticos como válvulas cardíacas ou desfibriladores implantáveis.
Por que essa classificação é tão importante? Porque, em nossa experiência, quanto maior a classe de risco do seu dispositivo, mais rigorosas serão as verificações regulatórias e mais extensa será a evidência que você precisará fornecer para o registro de dispositivos médicos em Hong Kong.
2. Requisitos do Fabricante: O Que É Esperado de Você?
Como fabricante, você tem algumas responsabilidades-chave. O que normalmente consideramos crucial aqui?
- Deve ter uma licença de fabricação válida: Este é seu permissão básica para operar.
- Deve implementar um sistema de gestão da qualidade: De acordo com nossa compreensão, isso geralmente significa ter um sistema como ISO 13485 em vigor para garantir qualidade consistente. Isso é vital para a conformidade de dispositivos médicos em Hong Kong.
- Deve manter documentação técnica: Mantenha registros detalhados do design, fabricação e testes do seu dispositivo.
- Deve cumprir normas internacionais: Alinhar-se com padrões globais ajuda a garantir que seu dispositivo atenda a critérios elevados de segurança e desempenho.
3. Pessoa Responsável Local (LRP): Seu Parceiro em Hong Kong
Para fabricantes estrangeiros, nomear uma Pessoa Responsável Local (LRP) é inegociável. Então, o que exatamente faz um LRP e por que eles são tão vitais?
- Deve ser uma empresa registrada em Hong Kong: Eles precisam ser uma entidade legal baseada localmente.
- Deve ter um registro comercial válido: Isso prova sua legitimidade.
- Deve manter a documentação adequada: Eles ajudam a manter todos os seus registros locais em ordem.
- Deve garantir conformidade regulatória: Em nossa experiência, o LRP atua como seu principal contato com a Divisão de Dispositivos Médicos (MDD), garantindo que todas as regulamentações de dispositivos médicos em Hong Kong sejam atendidas. Este papel é essencial para os requisitos de LRP em Hong Kong.
Procedimentos de Registro: Como Você Se Lista?
Pronto para ter seu dispositivo oficialmente listado? Aqui está nosso guia passo a passo para os procedimentos:
1. Preparação Pré-Submissão: Colocando Tudo em Ordem
Antes de clicar em "enviar", uma preparação minuciosa é fundamental para evitar atrasos. Em que você deve se concentrar nesta fase?
- Preencher formulários de solicitação: Preencha todos os formulários necessários com precisão.
- Preparar documentação técnica: É aqui que seu Resumo da Documentação Técnica (STED) entra em cena, um resumo conciso do arquivo técnico do seu dispositivo.
- Organizar documentos de apoio: Reúna todos os certificados, relatórios de teste e outras evidências.
- Garantir que todos os requisitos sejam atendidos: Verifique tudo em relação às diretrizes do MDACS.
2. Requisitos de Documentação: Que Documentação Você Precisa?
Que tipo de informações detalhadas a MDD estará procurando? De nossa experiência, um dossiê de solicitação abrangente geralmente inclui:
- Descrição e especificações do dispositivo: O que é seu dispositivo e quais são suas principais características?
- Informações de fabricação: Como é feito e onde?
- Procedimentos de controle de qualidade: Como você garante sua qualidade durante a produção?
- Análise e gestão de riscos: Quais são os riscos e como você os está controlando?
- Dados de avaliação clínica: Evidências do desempenho do seu dispositivo em ambientes do mundo real.
- Rotulagem e instruções: Todas as embalagens, rótulos do dispositivo e instruções para uso seguro. É aqui que entram os requisitos adicionais de rotulagem em Hong Kong (TR-005), garantindo conteúdo bilíngue.
3. Sistema de Gestão da Qualidade: Provando Seu Compromisso com a Qualidade
Um robusto Sistema de Gestão da Qualidade (QMS) é central para o MDACS. O que isso significa na prática para você?
- Deve cumprir com a ISO 13485: Este é o padrão internacionalmente reconhecido para QMS de dispositivos médicos.
- Deve incluir procedimentos de controle de qualidade: Etapas para monitorar e manter a qualidade do produto.
- Deve manter a documentação adequada: Mantenha registros de todas as atividades do QMS.
- Deve realizar auditorias regulares: Revise periodicamente seu QMS para garantir que seja eficaz.
Considerações Especiais: Situações Únicas
Existem situações únicas que requerem atenção extra? Absolutamente. Com base em nossa experiência, aqui estão algumas áreas-chave:
1. Dispositivos Sob Medida: Feitos Apenas para Um
E se seu dispositivo for feito especificamente para um único paciente? Esses dispositivos "sob medida" têm regras distintas:
- Requisitos especiais de documentação: Registros mais personalizados são frequentemente necessários.
- Medidas de controle de qualidade: Garantindo qualidade mesmo para produção única.
- Procedimentos de gestão de riscos: Avaliando riscos específicos para o paciente individual.
- Vigilância pós-mercado: Mesmo dispositivos sob medida precisam de monitoramento.
2. Investigação Clínica: Testando na Vida Real
Se seu dispositivo precisar de ensaios clínicos, há etapas específicas. O que você deve se preparar?
- Requisitos de aprovação: Obter a luz verde necessária para seu estudo.
- Necessidades de documentação: Planos detalhados e registros da investigação.
- Monitoramento de segurança: Verificando constantemente qualquer evento adverso durante o estudo.
- Requisitos de relatório: Submeter descobertas à MDD.
3. Requisitos de Importação/Exportação: Movendo Seu Dispositivo Através de Fronteiras
Pensando em trazer seu dispositivo para Hong Kong ou enviá-lo para fora? Você precisará saber sobre:
- Requisitos de licença de importação: Seu dispositivo precisa de um permissão especial para entrar? Isso é relevante para a importação de dispositivos médicos em Hong Kong.
- Documentação de exportação: Que papelada é necessária para o envio internacional?
- Procedimentos de liberação aduaneira: Navegando pela logística do controle de fronteira.
- Conformidade regulatória: Garantindo que você atenda a todas as regulamentações comerciais e de segurança.
Requisitos Pós-Mercado: O Que Acontece Após a Listagem?
É o fim de suas responsabilidades ao ser listado? De acordo com nossa experiência, definitivamente não! Manter a conformidade de dispositivos médicos em Hong Kong é um compromisso contínuo.
1. Sistema de Vigilância: Mantendo um Olho Atento
Como você mantém os dispositivos seguros uma vez que estão no mercado? O MDACS de Hong Kong enfatiza um robusto sistema de vigilância:
- Relato de eventos adversos: Informar prontamente a MDD sobre quaisquer problemas ou incidentes. Isso é crucial para o relato de eventos adversos de dispositivos médicos em Hong Kong.
- Ações corretivas de segurança em campo: Tomar as medidas necessárias para corrigir problemas com dispositivos já distribuídos.
- Procedimentos de recall: Ter um plano claro para retirar dispositivos inseguros do mercado.
- Requisitos de comunicação: Manter todos os interessados informados.
2. Conformidade Contínua: A Jornada Contínua
O que significa conformidade contínua na prática?
- Atualizações de documentação: Manter seus arquivos técnicos e registros atualizados.
- Manutenção do sistema de qualidade: Revisar e melhorar regularmente seu QMS.
- Auditorias regulares: Realizar verificações internas e externas para garantir a adesão aos padrões.
- Gestão de mudanças: Gerenciar e relatar adequadamente quaisquer modificações em seu dispositivo listado (conforme GN-10). Isso garante uma contínua vigilância pós-mercado em Hong Kong.
Informações de Contato
Para mais informações ou assistência, sempre recomendamos entrar em contato com a fonte oficial:
- Divisão de Dispositivos Médicos, Departamento de Saúde
- Site: www.mdd.gov.hk
Notas Importantes: Nossos Conselhos Práticos
Com base em nossa experiência, aqui estão algumas conclusões-chave a serem lembradas:
1. Cronograma de Conformidade: Planeje com Antecedência!
- Permita tempo suficiente para revisão: Os processos de registro podem levar um tempo, então paciência e planejamento são fundamentais.
- Planeje para solicitações de informações adicionais: É comum que a MDD peça mais detalhes; responder rapidamente é vital.
- Considere os requisitos pós-mercado: Leve em conta os custos contínuos de vigilância e conformidade desde o início.
- Monitore atualizações regulatórias: Mantenha-se informado sobre quaisquer mudanças nas regras.
2. Melhores Práticas: Nossas Principais Dicas para o Sucesso
- Engajamento precoce com a MDD: Não hesite em entrar em contato com perguntas.
- Preparação completa da documentação: Um dossiê completo acelera significativamente o processo.
- Monitoramento regular da conformidade: Fique de olho em seus processos internos.
- Mantenha registros adequados: Uma boa manutenção de registros facilita tudo a longo prazo.
3. Considerações de Custo: E Quanto ao Investimento?
Que tipo de custos você deve antecipar?
- Taxas de solicitação: Taxas para enviar sua solicitação de listagem.
- Custos de teste: Custos associados a testes de segurança e desempenho exigidos.
- Custos contínuos de conformidade: Despesas para manter seu QMS, serviços de LRP e atividades pós-mercado.
- Manutenção de documentação: O custo de manter seus arquivos técnicos atualizados.
Para nossa compreensão, ao manter esses aspectos em mente, você pode abordar o registro de dispositivos médicos em Hong Kong com confiança e garantir um caminho mais suave para o sucesso no mercado.
Pergunte Qualquer Coisa
Entraremos em contato pessoalmente.
Precisa de Orientação Especializada?
Explore Nosso Guia Interativo de Dispositivos Médicos
Obtenha orientação passo a passo sobre as regulamentações de dispositivos médicos de Hong Kong, classificação de dispositivos e requisitos de conformidade.
Ver Guia de Dispositivos MédicosEntre em contato conosco em contact@elendilabs.com / +852 4416 5550
Artigos Relacionados
Aproximadamente 5 minutos
Relato de Eventos Adversos de Dispositivos Médicos em Hong Kong: Um Guia para LRPs
A notificação de eventos adversos é um componente crítico do Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), com o objetivo de melhorar a saúde e a segurança pública. Este artigo descreve os requisitos e responsabilidades das Pessoas Responsáveis Locais (LRPs) na notificação de eventos adversos relacionados a dispositivos médicos listados, com base em nossas percepções.
Aproximadamente 5 minutos
Regulamentações e Registro de Dispositivos Médicos em Hong Kong
Guia completo sobre regulamentações de dispositivos médicos, classificação, requisitos de registro e vigilância pós-comercialização em Hong Kong.
Aproximadamente 5 minutos
Navegando nas Regulamentações de Dispositivos Médicos em Hong Kong: A Estrutura MDACS
O Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) de Hong Kong fornece uma estrutura robusta, embora atualmente voluntária, para a regulamentação de dispositivos médicos. Este artigo explora as principais características do sistema, incluindo a classificação de dispositivos, o processo de listagem, o papel crucial das Pessoas Responsáveis Locais (LRPs) e sua importância crescente para o acesso ao mercado e a aquisição pública, tudo a partir de nossas percepções e experiências.
Aproximadamente 5 minutos
Procedimentos de Listagem para Fabricantes Locais de Dispositivos Médicos em Hong Kong: Um Guia para GN-08
Este artigo detalha o processo de aplicação para fabricantes locais de dispositivos médicos que buscam ser listados sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme orientado pelo GN-08. Ele abrange elegibilidade, requisitos do sistema de gestão da qualidade e o processo de submissão, tudo baseado em nossas percepções e experiências para uma fabricação eficaz de dispositivos médicos em Hong Kong.
Aproximadamente 5 minutos
Procedimentos de Listagem para Importadores de Dispositivos Médicos em Hong Kong: Um Guia para GN-07
Para entidades que importam dispositivos médicos para Hong Kong, o Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) oferece um esquema de listagem voluntária para importadores, orientado pela GN-07. Este artigo detalha a elegibilidade, os passos de aplicação e os principais requisitos para a listagem como importador de dispositivos médicos, com base em nossas percepções e experiências para uma importação eficiente de dispositivos médicos em Hong Kong.
Aproximadamente 5 minutos
Procedimentos de Listagem para Distribuidores de Dispositivos Médicos em Hong Kong: Um Guia para GN-09
Este artigo descreve o processo de aplicação para distribuidores de dispositivos médicos que buscam ser listados sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme detalhado no GN-09. Ele abrange elegibilidade, requisitos-chave para procedimentos documentados e o processo de submissão para aprimorar a rastreabilidade e a segurança pública, com base em nossas percepções.
Aproximadamente 5 minutos
Procedimentos de Listagem para Dispositivos Médicos de Diagnóstico In Vitro de Classe B, C e D em Hong Kong: Um Guia para GN-06
Este artigo detalha o processo de aplicação para listar Dispositivos Médicos de Diagnóstico In Vitro de Classe B, C e D (IVDMDs) sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme orientado pelo GN-06. Ele abrange classificação, elegibilidade, requisitos de submissão e a aplicação online via MDIS, tudo baseado em nossos insights e experiência para uma listagem eficiente de IVDMD em Hong Kong.