Navegando nas Regulamentações de Dispositivos Médicos em Hong Kong: Um Guia Simples
Já se perguntou como os dispositivos médicos em Hong Kong são utilizados com segurança em hospitais e clínicas? É uma jornada que envolve regras rigorosas e supervisão cuidadosa. Para nossa compreensão, garantir que esses dispositivos sejam seguros, eficazes e de alta qualidade é fundamental para o bem-estar dos pacientes aqui em Hong Kong. Vimos em primeira mão como um sistema robusto é crucial, e é exatamente isso que Hong Kong construiu com seu Sistema de Controle de Dispositivos Médicos (MDACS).
Qual é a Situação das Regulamentações de Dispositivos Médicos em Hong Kong?
De nossa experiência, muitas pessoas acham "regulamentações" um pouco intimidadoras. Mas pense assim: essas regras estão em vigor para proteger você e seus entes queridos quando você interage com dispositivos médicos.
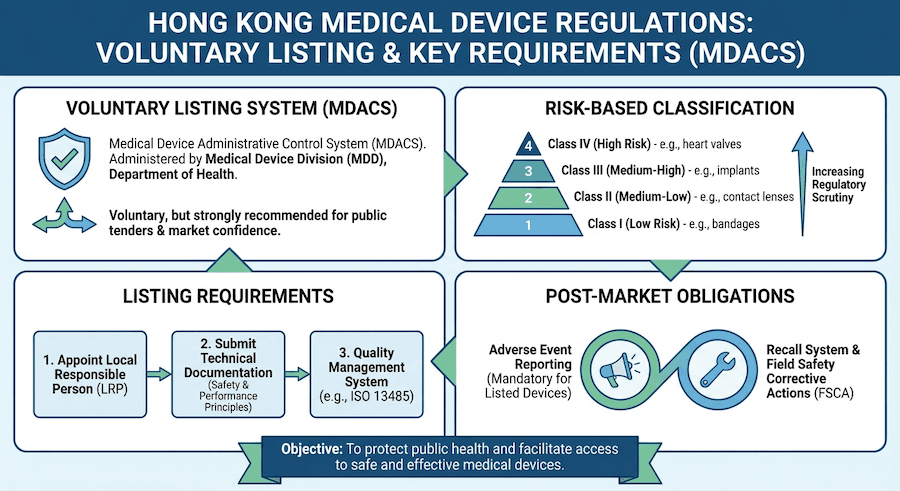
Então, quem está no comando de tudo isso? De acordo com nosso conhecimento, é principalmente o Departamento de Saúde, especificamente seu Escritório de Controle de Dispositivos Médicos. Eles comandam a operação sob o Sistema de Controle Administrativo de Dispositivos Médicos (MDACS), que é a pedra angular da supervisão de dispositivos médicos aqui.
As Regras Básicas: Legislação Chave
Descobrimos que entender as leis básicas ajuda. Aqui estão as principais que normalmente mencionamos:
- Sistema de Controle Administrativo de Dispositivos Médicos (MDACS): Este é o principal, a espinha dorsal da regulamentação.
- Ordinança de Importação e Exportação (Cap. 60): Como você pode imaginar, trazer dispositivos para Hong Kong requer procedimentos adequados.
- Ordinança de Descrições Comerciais (Cap. 362): Isso garante que o que um dispositivo afirma fazer seja realmente verdade – informações enganosas não são permitidas!
- Ordinança de Segurança de Produtos de Consumo (Cap. 456): Embora os dispositivos médicos tenham suas próprias regras específicas, esta ordem geral de segurança ajuda a garantir a proteção do consumidor.
Quem é Quem no Mundo Regulatório?
Quando falamos sobre o cenário regulatório, vários atores principais estão envolvidos:
- Departamento de Saúde (Escritório de Controle de Dispositivos Médicos): Essas são as principais pessoas com quem você interagirá.
- Comitê Consultivo de Dispositivos Médicos: Pense neles como o painel de especialistas oferecendo orientação.
- Comitês de Revisão Técnica: Esses grupos mergulham nos detalhes técnicos minuciosos dos dispositivos.
- Unidades de Inspeção e Fiscalização: Eles estão no campo, garantindo que todos estejam seguindo as regras.
Como os Dispositivos Médicos são Classificados? Tudo se Resume ao Risco!
Você já pensou por que alguns dispositivos médicos são tratados de forma diferente de outros? De nossa perspectiva, tudo se resume ao risco. Imagine um simples curativo versus um marcapasso – o impacto potencial em um paciente é vastamente diferente! O sistema de Hong Kong classifica os dispositivos com base em seu nível de risco.
A "Escada de Risco": Nosso Sistema de Classificação
Para nossa compreensão, os dispositivos são categorizados em quatro classes, como degraus de uma escada, do menor para o maior risco:
- Classe I: Dispositivos de baixo risco. Pense em itens do dia a dia.
- Classe II: Dispositivos de risco médio. Um pouco mais complexos.
- Classe III: Dispositivos de risco médio-alto. Agora a coisa fica séria.
- Classe IV: Dispositivos de alto risco. Esses são os que precisam de mais escrutínio cuidadoso.
O que Torna um Dispositivo "Arriscado"? Critérios Chave que Consideramos:
Quando avaliamos a classificação de um dispositivo, consideramos coisas como:
- Quanto tempo ele toca seu corpo? Um toque rápido versus algo implantado por anos.
- Quão invasivo é? Ele apenas repousa sobre sua pele ou entra em seu corpo?
- Ele afeta apenas um ponto ou todo o seu sistema?
- É "ativo" (precisa de energia) ou "não ativo"?
- Onde no corpo é utilizado? Áreas críticas como o coração ou o cérebro exigem cuidados extras.
Registrando Seu Dispositivo Médico: O que Você Precisa Saber
Todo dispositivo médico em Hong Kong está registrado? Não necessariamente! Com base em nossa experiência, embora o sistema MDACS seja voluntário, certos dispositivos precisam absolutamente ser registrados para serem legalmente comercializados e utilizados aqui.
Dispositivos que Precisam ser Registrados sob o MDACS:
Se você está lidando com esses tipos de dispositivos, o registro é tipicamente obrigatório:
- Dispositivos Classe II, III e IV: Como discutimos, esses são os de risco médio a alto.
- Dispositivos de diagnóstico in vitro: Pense em testes de laboratório e kits de diagnóstico.
- Dispositivos implantáveis ativos: Como marcapassos, esses vão dentro do corpo e precisam de energia.
- Dispositivos estéreis: Qualquer dispositivo que precisa estar completamente livre de germes para seu uso pretendido.
- Dispositivos com funções de medição: Pense em termômetros ou monitores de pressão arterial – a precisão é fundamental!
Dispositivos que Podem Ser Isentos:
Por outro lado, alguns dispositivos podem ser dispensados do registro obrigatório:
- Dispositivos Classe I não estéreis: Itens simples e de baixo risco que não precisam ser estéreis.
- Dispositivos sob medida: Dispositivos únicos feitos para um paciente específico.
- Dispositivos para investigação clínica: Aqueles que estão sendo testados em ensaios.
- Certos dispositivos tradicionais: Alguns tipos mais antigos e bem estabelecidos.
- Dispositivos de uso emergencial: Aqueles usados em situações urgentes onde o acesso imediato é crítico.
A Jornada de Registro: Um Olhar Passo a Passo
Então, você tem um dispositivo que precisa ser registrado. Como é o processo? De nossa perspectiva, envolve algumas etapas chave.
Antes de Enviar: Preparando-se
Pense nessas etapas como seus passos de preparação, essenciais para uma aplicação tranquila:
- Descubra a classe do seu dispositivo: Este é o primeiro passo, e como você sabe, determina muito do que vem a seguir.
- Configure seu sistema de gestão da qualidade: Não podemos enfatizar isso o suficiente – um sistema de qualidade robusto, como ISO 13485, é fundamental.
- Reúna evidências clínicas: Você tem dados que provam que seu dispositivo funciona e é seguro?
- Prepare documentos técnicos: Todas as especificações, designs e resultados de testes.
- Nomeie um representante autorizado: Você precisará de um contato local para lidar com as coisas em Hong Kong.
O que Enviar: A Lista de Verificação da Aplicação
Quando você estiver pronto para enviar, aqui está o que você normalmente precisará incluir:
- O formulário de aplicação oficial e taxas.
- Uma descrição clara do dispositivo e especificações.
- Certificados de gestão da qualidade, provando que seu sistema está em conformidade.
- Relatórios de avaliação clínica, mostrando as evidências de segurança e desempenho.
- Rotulagem e instruções de uso – estas devem ser claras e em conformidade.
Mergulhando nos Detalhes Técnicos: Documentação e Qualidade
Quando se trata de dispositivos médicos, os detalhes importam. Muito. Para nossa compreensão, a documentação técnica e os sistemas de gestão da qualidade são onde a coisa realmente acontece.
O que Significa "Documentação Técnica"?
Em termos simples, é a história completa do seu dispositivo, no papel. Ela responde a todas as perguntas de "como" e "por que". Coisas chave que procuramos incluem:
- Detalhes de design e fabricação do dispositivo: Como foi feito? Quais materiais foram usados?
- Documentação de gestão de riscos: Como você identificou e gerenciou riscos potenciais?
- Dados de avaliação clínica: A prova de que é seguro e eficaz.
- Planos de vigilância pós-mercado: Como você vai monitorar uma vez que esteja no mercado?
- Certificados de sistema de gestão da qualidade: Evidência de seus processos de qualidade robustos.
Apoio às Suas Afirmativas: Documentos Importantes
Além dos documentos principais, você frequentemente precisará de papelada de apoio:
- Certificados ISO 13485: Um padrão reconhecido globalmente para a qualidade de dispositivos médicos.
- Relatórios e certificados de teste: Prova de que seu dispositivo atende a vários padrões de segurança e desempenho.
- Relatórios de estudos clínicos: Resultados detalhados de quaisquer ensaios.
- Revisões de literatura: O que a pesquisa existente diz sobre dispositivos semelhantes?
- Comparações com dispositivos predicados: Como seu dispositivo se compara a dispositivos semelhantes já aprovados?
Sistemas de Gestão da Qualidade: A Base da Confiança
O que é um Sistema de Gestão da Qualidade (SGQ)? Simplificando, é como uma empresa garante que seus produtos atendam consistentemente aos requisitos e à satisfação do cliente. Para dispositivos médicos, isso é absolutamente crítico. Nossa experiência nos diz que um SGQ forte, particularmente um alinhado com ISO 13485, é inegociável.
Os Pilares da ISO 13485: O que Focamos
Este padrão internacional orienta como as empresas de dispositivos médicos devem operar. Ele abrange áreas como:
- Responsabilidade da gestão: Compromisso da liderança com a qualidade.
- Gestão de recursos: Ter as pessoas e ferramentas certas.
- Realização do produto: Desde o design até a fabricação.
- Medição e melhoria: Verificação constante e aprimoramento.
- Integração da gestão de riscos: Incorporando o controle de riscos em tudo.
Obtendo Certificação: O Papel dos Organismos de Certificação
Você não apenas "diz" que tem um SGQ; você o certifica. Isso geralmente envolve:
- Reconhecimento de organismos notificados: Trabalhar com organizações aprovadas.
- Requisitos de acreditação: Atender a padrões específicos para certificação.
- Auditorias de vigilância: Verificações regulares para garantir conformidade contínua.
- Manutenção de certificados: Manter sua certificação atual.
- Gestão de não conformidades: O que acontece quando algo dá errado? Como você corrige?
Evidência Clínica: Provando que Seu Dispositivo Funciona (e é Seguro!)
Como sabemos que um dispositivo médico realmente vai ajudar, e não prejudicar? É aqui que a evidência clínica entra. De nossa compreensão, isso é essencialmente a prova científica de que seu dispositivo faz o que se propõe a fazer e é seguro para os pacientes.
Como Avaliamos a Evidência Clínica
Analisamos várias maneiras de reunir essas informações cruciais:
- Revisão de literatura: O que os estudos científicos já dizem sobre dispositivos ou tecnologias semelhantes?
- Investigações clínicas: Realizando estudos com pacientes reais.
- Acompanhamento clínico pós-mercado: Continuando a coletar dados após o dispositivo estar no mercado.
- Demonstrações de equivalência: Mostrando que seu dispositivo é tão bom quanto um que já foi comprovado.
- Análise de risco-benefício: Pesando os benefícios potenciais contra quaisquer riscos possíveis.
Levando a Sério as Investigações Clínicas
Se uma investigação clínica for necessária, existem regras rigorosas a seguir:
- Desenvolvimento de protocolo: Um plano claro para o estudo.
- Aprovação do comitê de ética: Garantindo que o estudo seja ético e proteja os pacientes.
- Qualificações do investigador: Garantindo que as pessoas que conduzem o estudo sejam qualificadas.
- Conformidade com as Boas Práticas Clínicas (BPC): Seguindo padrões internacionais para ensaios clínicos.
- Relatórios de segurança: Relatando imediatamente quaisquer problemas inesperados.
Rotulando Seu Dispositivo: O que Precisa Ser Dito?
Já pegou um produto e se perguntou o que todas aquelas palavras pequenas significam? Para dispositivos médicos, cada palavra naquele rótulo é crítica. Para nossa compreensão, uma rotulagem clara e abrangente é essencial tanto para usuários quanto para pacientes.
Quais Informações São Indispensáveis?
Quando falamos sobre rotulagem de dispositivos médicos, estas são as peças-chave de informação que você não pode pular:
- Nome e modelo do dispositivo: Identificação simples.
- Informações do fabricante: Quem o fez?
- Uso pretendido e indicações: Para que serve? Quem deve usá-lo?
- Contraindicações e avisos: Quando não usá-lo e quais perigos observar.
- Instruções de uso: Como você realmente o utiliza de forma segura e eficaz?
Linguagem e Aparência: O que Mais Consideramos?
Além das palavras, existem outros aspectos importantes:
- Rotulagem em inglês obrigatória: É o padrão.
- Tradução para o chinês recomendada: Para atender melhor à população local, é sempre uma boa ideia incluir o chinês.
- Padrões de uso de símbolos: Símbolos reconhecidos podem transmitir informações rapidamente.
- Requisitos de tamanho de fonte: As pessoas conseguem realmente ler?
- Especificações de durabilidade: O rótulo durará tanto quanto o dispositivo?
Após a Venda: Vigilância Pós-Mercado
Só porque um dispositivo médico está no mercado não significa que a supervisão pare. Na verdade, de acordo com nossa experiência, a vigilância pós-mercado é uma parte contínua e vital para garantir a segurança e qualidade contínuas. Pense nisso como uma rede de segurança.
O Sistema "Cão de Guarda": Vigilância
Este sistema é todo sobre manter um olho nos dispositivos uma vez que estão no mundo real:
- Relato de eventos adversos: Se algo der errado, precisa ser relatado.
- Ações corretivas de segurança em campo: Se um problema generalizado for encontrado, quais passos são tomados para corrigi-lo?
- Relatórios periódicos de atualização de segurança: Atualizações regulares sobre o perfil de segurança do dispositivo.
- Atualizações de gestão de riscos: Reavaliando e gerenciando riscos constantemente.
- Atividades de vigilância de mercado: Procurando proativamente por problemas.
Relatando Problemas: Nossas Obrigações
Todos nós temos um papel a desempenhar na comunicação de problemas. Aqui está uma visão rápida dos prazos de relato que normalmente seguimos:
- Quaisquer eventos adversos que tenham representado ou possam representar um risco à saúde pública: 48 horas
- Quaisquer eventos adversos que resultaram em morte ou lesão grave: 10 dias
- Todos os outros eventos adversos que precisam ser relatados: 30 dias
- Relatório final de acompanhamento: dentro de 30 dias corridos a partir dos relatórios iniciais
Colocando Dispositivos em Hong Kong: Importação e Distribuição
Então, um dispositivo é aprovado – como ele realmente entra no país e chega às pessoas certas? Isso envolve regras específicas de importação e distribuição. Para nossa compreensão, essas etapas garantem a integridade da cadeia de suprimentos de dispositivos médicos.
Trazendo Dispositivos: Requisitos de Importação
Se você está importando dispositivos médicos, geralmente precisará:
- Licença de comerciante de dispositivos médicos
- Permissões de importação
- Declarações aduaneiras
- Certificados de qualidade
- Protocolos de armazenamento e manuseio
Levando Dispositivos aos Usuários: Controles de Distribuição
Uma vez que os dispositivos estão em Hong Kong, como são distribuídos também é regulamentado:
- Distribuidores autorizados
- Integridade da cadeia de suprimentos
- Condições de armazenamento
- Procedimentos de recall
- Sistemas de rastreabilidade
Casos Especiais: Dispositivos IVD, Software e Produtos Combinados
Nem todos os dispositivos médicos são iguais, e alguns têm considerações únicas. De nossa experiência, essas categorias frequentemente requerem uma análise mais profunda.
Dispositivos de Diagnóstico In Vitro (IVD): O Mundo dos Testes de Laboratório
Pense nos IVDs como as ferramentas usadas para diagnosticar condições a partir de amostras como sangue ou urina. Eles têm seu próprio conjunto de requisitos:
- Avaliação de desempenho: Ele detecta com precisão o que se propõe a detectar?
- Desempenho analítico: Quão bem mede o que se propõe a medir?
- Desempenho clínico: Quão bem ele se desempenha em um ambiente clínico real?
- Materiais de controle de qualidade: Como você garante resultados consistentes?
- Padrões de referência: Quais são os benchmarks para precisão?
Critérios de Classificação para IVDs (Frequentemente Específicos):
- Dispositivos de auto-teste
- Testes próximos ao paciente
- Análises de alto risco
- Dispositivos de agrupamento sanguíneo
- Testes de doenças infecciosas
Software como Dispositivo Médico (SaMD): Aplicativos e Algoritmos
Você sabia que software pode ser um dispositivo médico? Absolutamente! Para nossa compreensão, à medida que a tecnologia evolui, as regulamentações também precisam evoluir.
Abordagem Regulatória para SaMD:
- Classificação de software: Assim como dispositivos físicos, o software é classificado por risco.
- Requisitos de cibersegurança: Proteger dados dos pacientes e a funcionalidade do dispositivo é fundamental.
- Validação e verificação: O software faz o que foi projetado para fazer, de forma confiável?
- Procedimentos de controle de mudanças: Como são tratadas atualizações e modificações?
- Monitoramento pós-mercado: Mantendo um olho no desempenho do software após o lançamento.
Documentação Essencial para SaMD:
- Processos de ciclo de vida do software
- Arquivos de gestão de riscos
- Avaliação clínica
- Engenharia de usabilidade
- Documentação de cibersegurança
Produtos Combinados: Quando Dispositivos se Misturam com Outras Coisas
Às vezes, um dispositivo médico não é apenas um dispositivo. Ele pode ser combinado com um medicamento ou um produto biológico. Esses são chamados de produtos combinados.
Combinações de Medicamentos e Dispositivos:
- Modo primário de ação: É principalmente um medicamento ou um dispositivo? Isso determina o principal caminho regulatório.
- Determinação do caminho regulatório
- Processo de revisão integrada: Muitas vezes, os aspectos de medicamento e dispositivo são revisados juntos.
- Requisitos de qualidade
- Avaliação clínica
Combinações Biológicas e Dispositivos:
- Interação de componentes: Como as partes biológicas e do dispositivo funcionam juntas?
- Controles de fabricação
- Validação de esterilização
- Testes de biocompatibilidade: O dispositivo interage de forma segura com materiais biológicos?
- Avaliação clínica
Harmonia Internacional e Tendências Futuras
Hong Kong é uma ilha quando se trata de regulamentações de dispositivos médicos? De forma alguma! De nossa compreensão, há um forte impulso para a cooperação internacional e para acompanhar os últimos avanços.
Harmonia Global: Trabalhando Juntos
Vimos Hong Kong participar ativamente de esforços globais para alinhar regulamentações:
- Fórum Internacional de Reguladores de Dispositivos Médicos (IMDRF): Um grupo chave promovendo a convergência global.
- Adoção de padrões ISO: Usando padrões reconhecidos internacionalmente.
- Acordos de reconhecimento mútuo: Reconhecendo aprovações de outros países confiáveis.
- Convergência regulatória
- Compartilhamento de melhores práticas
Cooperação Regional:
- Harmonização APEC
- Diretiva de dispositivos médicos da ASEAN
- Acordos bilaterais
- Troca de informações
- Inspeções conjuntas
O que Vem a Seguir? Tecnologias Emergentes
O mundo médico está constantemente inovando, e as regulamentações precisam acompanhar. Estamos vendo muito foco em:
- Saúde Digital:
- Aplicativos médicos móveis: Seu telefone pode se tornar uma ferramenta médica?
- Dispositivos de inteligência artificial (IA): IA auxiliando no diagnóstico ou tratamento.
- Plataformas de telemedicina: Soluções de saúde remota.
- Dispositivos vestíveis
- Sistemas de monitoramento remoto
- Terapias Avançadas:
- Produtos de medicina regenerativa: Novas maneiras de curar e reparar o corpo.
- Dispositivos de terapia gênica
- Sistemas de terapia celular
- Produtos de engenharia de tecidos
- Dispositivos de medicina personalizada: Tratamentos adaptados para indivíduos.
Mantendo-se em Conformidade e os Custos Envolvidos
A conformidade não é apenas uma sugestão; é uma necessidade. De nossa experiência, manter-se atualizado sobre as regulamentações é crucial para evitar problemas. E sim, há custos envolvidos.
Inspeções e Fiscalização: Mantendo Todos Honestamente
As autoridades realizam várias verificações para garantir a conformidade:
- Inspeções de instalações de fabricação: Visitando onde os dispositivos são feitos.
- Auditorias de distribuidores: Verificando como os dispositivos são armazenados e distribuídos.
- Vigilância de mercado: Monitorando produtos já no mercado.
- Investigações de reclamações
- Estudos pós-mercado
Se problemas forem encontrados, podem haver consequências sérias:
- Cartas de advertência
- Recall de produtos
- Suspensão de licença
- Processo criminal
- Penalidades administrativas
E Quanto ao Dinheiro? Considerações de Custos
Frequentemente nos perguntam sobre os custos. Não se trata apenas de taxas de registro:
- Taxas de Registro: Taxas de aplicação, taxas anuais, taxas de variação, taxas de inspeção, custos de certificação.
- Custos de Conformidade:
- Implementação de um sistema de qualidade robusto.
- Realização de estudos clínicos.
- Preparação de toda aquela documentação técnica.
- Vigilância pós-mercado contínua.
- Contratação de consultoria regulatória (como nós!).
Inovação e Apoio: Construindo um Futuro Mais Saudável
Embora as regulamentações sejam rigorosas, Hong Kong também apoia a inovação. De nossa compreensão, existem caminhos para ajudar novas tecnologias inovadoras a chegarem mais rapidamente aos pacientes.
Aceleração para Inovações:
Para dispositivos verdadeiramente inovadores, pode haver processos acelerados:
- Designação de dispositivo inovador: Status especial para tecnologia de ponta.
- Caminhos de revisão prioritária: Avaliação mais rápida.
- Aprovação acelerada
- Aprovações condicionais
- Autorizações de uso emergencial
Apoio à Indústria:
O Departamento de Saúde também oferece recursos para ajudar as empresas a navegar pelo sistema:
- Reuniões pré-submissão: Obtendo feedback inicial sobre sua aplicação.
- Documentos de orientação: Instruções claras sobre o que é necessário.
- Programas de treinamento
- Associações da indústria
- Caixas de areia regulatórias
Melhores Práticas e Desafios Comuns (e Como os Enfrentamos!)
Qual é o segredo para o sucesso no cenário de dispositivos médicos de Hong Kong? Em nossa experiência, tudo se resume a uma estratégia inteligente e gestão proativa da qualidade.
Nossas Melhores Práticas Recomendadas:
- Estratégia Regulatória:
- Engajamento precoce: Não espere até o último minuto para pensar sobre regulamentações.
- Planejamento abrangente: Mapeie toda a sua jornada.
- Avaliação de riscos: Entenda e mitigue problemas potenciais.
- Qualidade por design: Incorpore qualidade em seu dispositivo desde o início.
- Gestão do ciclo de vida
- Gestão da Qualidade:
- Melhoria contínua: Sempre procure maneiras de melhorar.
- Pensamento baseado em riscos: Foque recursos onde os riscos são mais altos.
- Otimização de processos
- Desenvolvimento de competências
- Foco no cliente
Enfrentando os Obstáculos: Desafios Comuns que Vemos
Frequentemente encontramos essas questões com nossos clientes:
- Incertezas de classificação: Às vezes é difícil descobrir exatamente em qual classe um dispositivo se enquadra.
- Requisitos de evidência clínica: Coletar dados robustos suficientes pode ser um grande desafio.
- Documentação técnica: O volume e o detalhe exigidos podem ser esmagadores.
- Cronogramas regulatórios: As coisas podem levar mais tempo do que o esperado.
- Gestão de custos: Manter as despesas sob controle durante todo o processo.
Nossas Soluções para Esses Desafios:
Com base em nossa experiência, aqui está como normalmente ajudamos a superar esses obstáculos:
- Consultoria especializada: Obtendo conselhos especializados desde o início.
- Inteligência regulatória: Mantendo-se atualizado sobre as últimas mudanças.
- Planejamento estratégico: Tendo um roteiro claro.
- Sistemas de qualidade: Investindo em processos internos fortes.
- Engajamento das partes interessadas: Trabalhando em estreita colaboração com todas as partes envolvidas.
Conclusão: Entendendo as Regulamentações de Dispositivos Médicos em Hong Kong
Para nossa compreensão, o sistema de regulamentação de dispositivos médicos de Hong Kong é uma estrutura bem pensada projetada para manter os pacientes seguros enquanto ainda incentiva novas tecnologias inovadoras. Pode parecer complexo à primeira vista, mas com uma compreensão clara dos requisitos, um compromisso com a qualidade e talvez um pouco de orientação especializada, navegar com sucesso por ele é absolutamente alcançável.
Anonymous
Our SaMD (Software as a Medical Device) performs diagnostic image analysis but does not directly control any hardware. Following the September 2025 update to TR-007, how does the MDD now interpret Classification Rule 12 for standalone software that lacks a 'direct medical purpose' in isolation but is intended for use with a specific imaging modality? Does this automatically trigger a Class II listing even if the software is technically 'standalone'?