Precisa de Ajuda Regulatória? Experimente Nossa Plataforma
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
14 de junho de 2025
Aproximadamente 5 minutos
Navegando nas Regulamentações de Dispositivos Médicos em Hong Kong: A Estrutura MDACS
Compreendendo o Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) em Hong Kong: Nossas Perspectivas
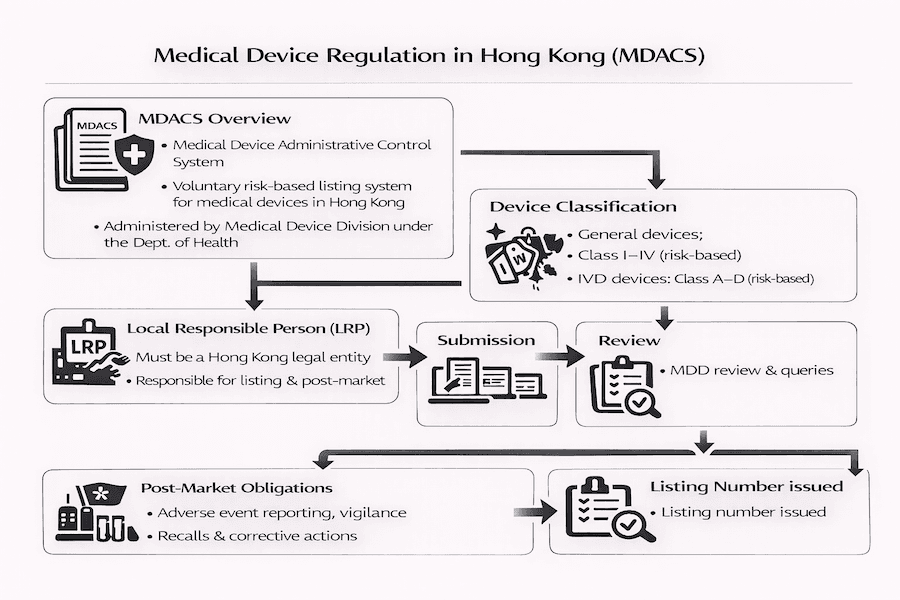
Pelo que vimos, Hong Kong tem uma maneira única de gerenciar dispositivos médicos, principalmente através de algo chamado Sistema de Controle Administrativo de Dispositivos Médicos (MDACS). O Departamento de Saúde (DH) lançou isso em novembro de 2004, e é gerenciado pela sua Divisão de Dispositivos Médicos (MDD). Para nosso entendimento, o MDACS é baseado em uma abordagem "baseada em risco". O que isso significa para você? Isso simplesmente significa que as regras e verificações se tornam mais rigorosas à medida que o potencial de risco de um dispositivo aumenta. Seu principal objetivo é garantir que todos os dispositivos médicos vendidos aqui sejam seguros, de boa qualidade e funcionem corretamente.
De acordo com nossa experiência, este sistema segue as melhores práticas internacionais, extraindo ideias de grupos globais como o Fórum Internacional de Reguladores de Dispositivos Médicos (IMDRF). Vemos o MDACS como um trampolim, preparando o caminho para futuras leis mais formais sobre dispositivos médicos.
Como os Dispositivos Médicos são Classificados em Hong Kong? Compreendendo as Categorias de Risco
Sob o MDACS, os dispositivos médicos são classificados em quatro grupos diferentes com base em quanto risco eles podem representar para pacientes e usuários. Essa classificação é super importante porque afeta diretamente a atenção que os reguladores darão ao seu dispositivo.
Dispositivos Médicos Gerais:
- Classe I (Baixo risco): Estes são os dispositivos mais simples com risco mínimo. Pense em itens do dia a dia, como um depressor de língua ou um curativo básico.
- Classe II (Risco baixo-moderado): Estes têm um pouco mais de risco envolvido. Exemplos comuns incluem lentes de contato ou aparelhos auditivos.
- Classe III (Risco moderado-alto): Consideramos esses dispositivos de maior risco. Este grupo inclui coisas como ventiladores usados em hospitais ou implantes de quadril.
- Classe IV (Alto risco): Estes são os dispositivos mais críticos, onde qualquer falha pode ter consequências muito sérias. De nossa perspectiva, marcapassos e válvulas cardíacas se enquadram nesta categoria de maior risco.
Da mesma forma, dispositivos médicos de diagnóstico in vitro (IVD) (aqueles usados para testar amostras fora do corpo, como exames de sangue) também são categorizados nas Classes A, B, C e D, do menor para o maior risco. A MDD fornece guias úteis (chamados de referências técnicas como TR-003 para dispositivos gerais e TR-006 para IVDs) para ajudar os fabricantes a determinar a classe correta. Isso depende de fatores como para que o dispositivo é usado, quanto tempo ele está em contato com o corpo, se envolve cirurgia e seu potencial de dano.
O Sistema de Listagem Voluntária: Por Que Ainda é Crucial
Uma parte fundamental do MDACS é seu sistema de listagem voluntária para dispositivos médicos de risco médio a alto (ou seja, dispositivos gerais das Classes II, III, IV e IVD Classes B, C, D). Então, a listagem é obrigatória? Ainda não para todos os dispositivos, mas pelo que vimos, oferece enormes benefícios. Hospitais públicos e outros grandes compradores em Hong Kong preferem cada vez mais, e em muitos casos até exigem, dispositivos que estão listados sob o MDACS. De acordo com nossa experiência, essa preferência crescente praticamente torna a listagem voluntária uma obrigação para realmente colocar seu produto no mercado de Hong Kong. Uma vez que um dispositivo é listado, sua aprovação geralmente dura cinco anos, então é importante ficar atento às datas de renovação.
O Papel Crítico da Pessoa Responsável Local (LRP): Nossa Experiência
Para qualquer fabricante fora de Hong Kong que deseja vender dispositivos médicos aqui, nomear uma Pessoa Responsável Local (LRP) é uma exigência absoluta. Quem é um LRP? Pense neles como seu vínculo local vital entre você, seus importadores, distribuidores, as pessoas que usam seus dispositivos e a Divisão de Dispositivos Médicos. De nossa experiência, suas responsabilidades são bastante extensas e cruciais para operações suaves, incluindo:
- Gerenciar todas as solicitações para listar seu dispositivo.
- Garantir que os canais de comunicação permaneçam abertos e claros.
- Gerenciar reclamações de clientes e acompanhar para onde os dispositivos vão (rastreabilidade).
- Relatar quaisquer mudanças feitas em dispositivos listados.
- Mais importante, relatar eventos adversos (quaisquer problemas ou incidentes inesperados) à MDD. O MDACS possui um Sistema de Relato de Eventos Adversos embutido, e de nossa perspectiva, é vital para investigar incidentes para evitar que aconteçam novamente e manter o público seguro.
O Processo de Solicitação de Listagem: O Que Esperar de Nossa Experiência
Os passos gerais para obter a listagem voluntária do seu dispositivo geralmente envolvem:
- Classificação do Dispositivo: Primeiro, você precisa determinar com precisão a classe de risco do seu dispositivo. Descobrimos que este passo inicial prepara o terreno para tudo o mais.
- Nomeação do LRP: Você então nomeia um LRP qualificado aqui em Hong Kong.
- Compilação do Dossiê: É aqui que muito do trabalho detalhado acontece. Você (ou seu LRP) prepara um conjunto abrangente de documentos de solicitação. De acordo com nossa experiência, garantir que este "dossiê" esteja alinhado com as diretrizes de submissão internacionais (como as do GHTF/IMDRF) pode realmente ajudar.
- Submissão e Revisão: Seu LRP submete a solicitação à MDD para revisão. Pelo que vimos, a MDD pode solicitar mais informações durante essa revisão, então respostas rápidas são fundamentais!
- Aprovação da Listagem: Se tudo parecer bom após a revisão, a MDD dará ao seu dispositivo um número de listagem único e o adicionará ao seu banco de dados público online.
E se seu dispositivo já estiver aprovado em outro lugar? Fabricantes cujos dispositivos já foram aprovados em "países de referência" reconhecidos (como os EUA, UE, Canadá, Japão, Austrália, Coreia ou China continental) podem ser capazes de passar por um processo de revisão mais rápido ou simples – o que é uma grande vantagem que frequentemente vemos sendo utilizada.
Acesso ao Mercado e a Área da Grande Baía (GBA): Expandindo Horizontes
A listagem no MDACS está se tornando cada vez mais importante, não apenas para vender em Hong Kong, mas também como um potencial portal para a empolgante Área da Grande Baía Guangdong-Hong Kong-Macau (GBA). Iniciativas como o Esquema Conectado da GBA estão, segundo nosso entendimento, permitindo que dispositivos médicos listados em Hong Kong sejam usados em hospitais e clínicas aprovados dentro da GBA. De nossa perspectiva, isso abre oportunidades significativas de expansão para os fabricantes, tornando Hong Kong um ponto de entrada ainda mais estratégico.
Perspectivas Futuras: Mantendo-se à Frente
Embora o MDACS atualmente opere como um sistema administrativo, sabemos que Hong Kong tem considerado seriamente a transição para uma estrutura legal obrigatória para dispositivos médicos. Essa potencial mudança destaca o compromisso contínuo de tornar a supervisão regulatória ainda mais forte e garantir os mais altos padrões de segurança e qualidade de dispositivos médicos na região. Nosso conselho para fabricantes e LRPs é sempre se manter atualizado com as últimas diretrizes e quaisquer novas leis que surgirem, pois isso é vital para garantir que você permaneça em conformidade e possa continuar a acessar este mercado dinâmico.
Pergunte Qualquer Coisa
Entraremos em contato pessoalmente.
Precisa de Orientação Especializada?
Explore Nosso Guia Interativo de Dispositivos Médicos
Obtenha orientação passo a passo sobre as regulamentações de dispositivos médicos de Hong Kong, classificação de dispositivos e requisitos de conformidade.
Ver Guia de Dispositivos MédicosEntre em contato conosco em contact@elendilabs.com / +852 4416 5550
Artigos Relacionados
Aproximadamente 5 minutos
Relato de Eventos Adversos de Dispositivos Médicos em Hong Kong: Um Guia para LRPs
A notificação de eventos adversos é um componente crítico do Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), com o objetivo de melhorar a saúde e a segurança pública. Este artigo descreve os requisitos e responsabilidades das Pessoas Responsáveis Locais (LRPs) na notificação de eventos adversos relacionados a dispositivos médicos listados, com base em nossas percepções.
Aproximadamente 5 minutos
Regulamentações e Registro de Dispositivos Médicos em Hong Kong
Guia completo sobre regulamentações de dispositivos médicos, classificação, requisitos de registro e vigilância pós-comercialização em Hong Kong.
Aproximadamente 5 minutos
Navegando nas Regulamentações de Dispositivos Médicos em Hong Kong: A Estrutura MDACS
O Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) de Hong Kong fornece uma estrutura robusta, embora atualmente voluntária, para a regulamentação de dispositivos médicos. Este artigo explora as principais características do sistema, incluindo a classificação de dispositivos, o processo de listagem, o papel crucial das Pessoas Responsáveis Locais (LRPs) e sua importância crescente para o acesso ao mercado e a aquisição pública, tudo a partir de nossas percepções e experiências.