ElendiLabs
在香港 MDACS 体系下,“制造商”是指对器械的设计、制造、包装和标签负最终法律责任的实体。如果您的香港总部掌握设计控制权且是 ISO 13485 证书的持有者,您可以尝试申请为“本地制造商”。 • 本土优势: 2026 年 CMPR 框架下,拥有“香港设计、香港监管”身份的产品在公立投标中通常拥有更高的技术评分。即使生产在内地,只要您的 QMS 体系将深圳工厂定义为受控的“外包供应商 (Outsourced Supplier)”,您仍有机会保留本地制造商的法律地位。
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
14 de junho de 2025
Aproximadamente 5 minutos
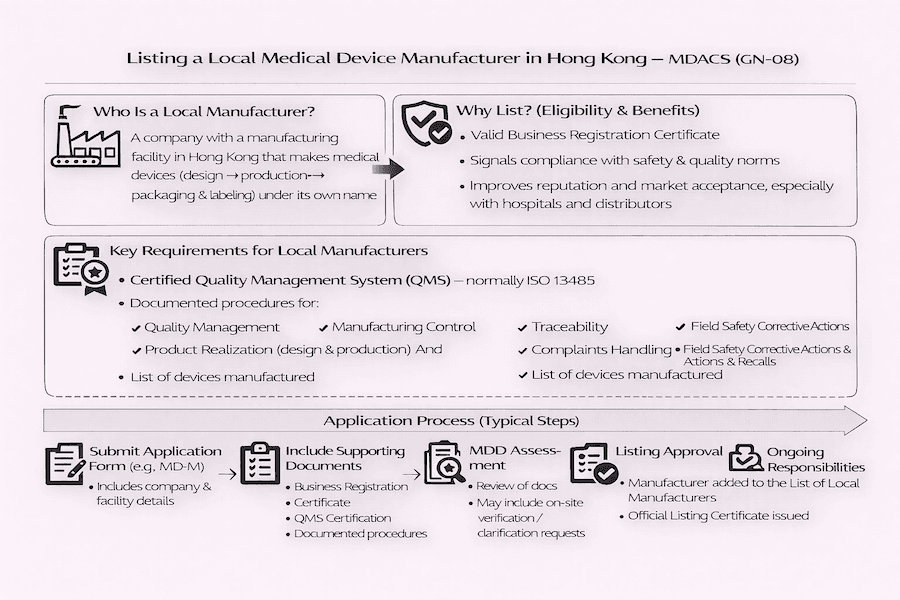
Para fabricantes aqui em Hong Kong que produzem dispositivos médicos, o Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) oferece um esquema de listagem voluntária. O que isso significa para a fabricação local de dispositivos médicos? Significa que há um caminho claro para mostrar seu compromisso com a qualidade. As diretrizes específicas para fabricantes locais estão claramente delineadas nas "Notas de Orientação para Listagem de Fabricantes Locais de Dispositivos Médicos" (GN-08). Este documento, segundo nossa compreensão, descreve os critérios e etapas principais para que empresas de fabricação locais provem sua dedicação à produção de dispositivos médicos seguros e confiáveis em Hong Kong.
Quando falamos sobre "dispositivos médicos" em Hong Kong, o que exatamente a Divisão de Dispositivos Médicos (MDD) do Departamento de Saúde considera como tal? De acordo com suas diretrizes, um dispositivo médico é essencialmente qualquer instrumento, aparelho, máquina, equipamento, implante, software, material ou item similar. É importante que o fabricante tenha a intenção de que ele seja usado, seja sozinho ou com outras coisas, para fins médicos específicos em humanos.
Esses fins incluem:
Crucialmente, um dispositivo médico não alcança seu efeito principal no corpo através de medicamentos, respostas imunológicas ou metabolismo. No entanto, ele pode ser auxiliado em sua função por tais meios. Portanto, é bastante amplo, abrangendo tudo, desde um simples curativo até softwares de diagnóstico complexos!
Sob o MDACS, um "Fabricante Local" refere-se a uma empresa ou entidade que fabrica ativamente dispositivos médicos aqui em Hong Kong. O que esse processo de fabricação geralmente envolve? De nossa perspectiva, inclui tudo, desde o design inicial e produção até a embalagem e rotulagem de dispositivos médicos antes de serem oficialmente colocados no mercado sob o nome desse fabricante. Essa definição ajuda a esclarecer as responsabilidades da fabricação de dispositivos médicos em Hong Kong.
Qualquer empresa legal com um Certificado de Registro de Empresa válido e uma instalação de fabricação localizada em Hong Kong, produzindo dispositivos médicos cobertos pelo MDACS, pode solicitar para ser adicionada à "Lista de Fabricantes Locais." Embora a listagem seja voluntária, de acordo com nossa experiência, oferece benefícios realmente significativos:
Para que sua operação de fabricação de dispositivos médicos em Hong Kong seja listada sob o MDACS, você precisa demonstrar que atende a requisitos específicos, com um foco muito forte em como você gerencia a qualidade. Qual é o requisito mais importante?
O processo de aplicação para listar sua operação de fabricação de dispositivos médicos local geralmente envolve estas etapas:
De nossa perspectiva, ser listado é uma conquista significativa, mas não é uma coisa única. Uma vez que você esteja na lista, os fabricantes locais têm o dever contínuo de manter seu SGQ certificado, seguir continuamente seus procedimentos documentados e informar prontamente à MDD sobre quaisquer mudanças em suas informações comerciais, métodos de fabricação ou nos próprios dispositivos médicos. Por que esse compromisso com a conformidade contínua é tão fundamental? Porque é o que garante a segurança, qualidade e eficácia contínuas dos dispositivos médicos fabricados em Hong Kong, beneficiando, em última análise, a saúde pública.
Entraremos em contato pessoalmente.
ElendiLabs
在香港 MDACS 体系下,“制造商”是指对器械的设计、制造、包装和标签负最终法律责任的实体。如果您的香港总部掌握设计控制权且是 ISO 13485 证书的持有者,您可以尝试申请为“本地制造商”。 • 本土优势: 2026 年 CMPR 框架下,拥有“香港设计、香港监管”身份的产品在公立投标中通常拥有更高的技术评分。即使生产在内地,只要您的 QMS 体系将深圳工厂定义为受控的“外包供应商 (Outsourced Supplier)”,您仍有机会保留本地制造商的法律地位。
Anonymous
目前 MDACS 的本地制造商表列主要是‘文件审核制’。但听说 2026 年底 CMPR 成立后会引入现场检查 (On-site Inspection)。对于我们这种租用小型无尘车间的本地企业,如果仓库空间不足或温控记录不全,会被直接撤销 HKMD 编号吗?LRP 在此类审计中承担什么法律责任?
ElendiLabs
是的,2026 年是香港监管从“被动接收”转向“主动飞行检查”的转折点。CMPR 审计将聚焦于追溯性 (Traceability) 和不良事件处理。 • 责任绑定: LRP 需要确保本地工厂的 SOP 符合 COP-01 守则。如果现场审计不合格,CMPR 有权吊销该制造商的所有相关产品列名。
Anonymous
我们是一家位于香港科学园的初创企业,生产一款 II 类物理治疗仪。目前我们的工厂表列申请仍处于‘补充资料’阶段。考虑到 2026 年 3 月 23 日 后,所有公立医院采购 (Stage C3) 必须持有最终的 HKMD 编号(不再接受 Stage B 的申请编号),如果我们在截止日期前未能拿到证书,是否意味着我们必须停供现有的医管局 (HA) 订单?有没有针对‘本地创新器械’的特殊加急通道?
ElendiLabs
2026 年 1 月的最新指引确认 Stage C 没有缓冲期。没有 HKMD 编号,产品将无法在 3 月 23 日后的标书中通过合规审查。 • 加急路径: 卫生署医疗器械分部 (MDD) 虽然没有官方的“加急费”政策,但对于在香港本地生产、且属于政府重点支持的创新器械(如入选 GBA 港澳药械通或科学园项目),LRP 可以向 MDD 提交 “采购紧急证明书 (Urgency Letter for Procurement)”,请求加速技术审评。ElendiLabs 建议您立即在 MDIS 门户 完善所有实验数据,以确保在最后 12 周内获批。
Obtenha orientação passo a passo sobre as regulamentações de dispositivos médicos de Hong Kong, classificação de dispositivos e requisitos de conformidade.
Ver Guia de Dispositivos MédicosEntre em contato conosco em contact@elendilabs.com / +852 4416 5550
Aproximadamente 5 minutos
A notificação de eventos adversos é um componente crítico do Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), com o objetivo de melhorar a saúde e a segurança pública. Este artigo descreve os requisitos e responsabilidades das Pessoas Responsáveis Locais (LRPs) na notificação de eventos adversos relacionados a dispositivos médicos listados, com base em nossas percepções.
Aproximadamente 5 minutos
Guia completo sobre regulamentações de dispositivos médicos, classificação, requisitos de registro e vigilância pós-comercialização em Hong Kong.
Aproximadamente 5 minutos
O Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) de Hong Kong fornece uma estrutura robusta, embora atualmente voluntária, para a regulamentação de dispositivos médicos. Este artigo explora as principais características do sistema, incluindo a classificação de dispositivos, o processo de listagem, o papel crucial das Pessoas Responsáveis Locais (LRPs) e sua importância crescente para o acesso ao mercado e a aquisição pública, tudo a partir de nossas percepções e experiências.
Aproximadamente 5 minutos
Este artigo detalha o processo de aplicação para fabricantes locais de dispositivos médicos que buscam ser listados sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme orientado pelo GN-08. Ele abrange elegibilidade, requisitos do sistema de gestão da qualidade e o processo de submissão, tudo baseado em nossas percepções e experiências para uma fabricação eficaz de dispositivos médicos em Hong Kong.
Anonymous
我们的研发和质量控制总部在香港,但实际组装位于深圳的关联工厂。根据 GN-01 指南,我们是否可以申请‘本地制造商 (Local Manufacturer)’身份以获得香港政府采购的本土优先权?还是由于生产基地在内地,必须作为‘海外制造商’并通过‘表列进口商’模式进行注册?