ElendiLabs
具有“指定值 (Assigned Values)”的校准品和质控品必须与主试剂保持一致,即 Class D,不能降级。 • 附件区分: 只有不具备特定诊断功能的通用耗材(如普通的样本杯或非特异性洗涤液)可以作为 Class A。但在 2026 年的 MDIS 系统申报中,为了确保 Stage C 采购流程的完整性,建议将整个 Test System 作为一个“系统 (System)”进行整体列名,这样可以避免因配件表列号缺失而导致医院收货受阻。
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
2 de junho de 2025
Aproximadamente 5 minutos
De nossa perspectiva, a introdução de Dispositivos Médicos de Diagnóstico In Vitro (IVDMDs) no mercado de Hong Kong requer uma navegação cuidadosa pelo Sistema de Controle Administrativo de Dispositivos Médicos (MDACS). Este sistema, administrado pelo Departamento de Saúde, oferece uma estrutura clara para a listagem voluntária de dispositivos médicos. Para aqueles que lidam com IVDMDs de Classe B, C e D, os procedimentos específicos de aplicação estão bem explicados nas "Notas de Orientação para Listagem de Dispositivos Médicos de Diagnóstico In Vitro de Classe B, C e D" (GN-06). De acordo com nossa experiência, entender essa orientação é absolutamente essencial para fabricantes e Pessoas Responsáveis Locais (LRPs) que desejam trazer esses dispositivos vitais para Hong Kong.
Antes mesmo de iniciar o processo de listagem, é super importante classificar seu IVDMD corretamente. Então, o que exatamente é um Dispositivo Médico de Diagnóstico In Vitro (IVDMD)? Simplificando, esses são dispositivos médicos usados fora do corpo humano para testar amostras (como sangue ou urina) para fornecer informações para diagnóstico, monitoramento ou para verificar compatibilidade. Para nosso entendimento, semelhante à forma como os dispositivos médicos gerais são classificados, os IVDMDs se enquadram em quatro categorias baseadas em risco:
A classificação de um IVDMD depende de fatores como para que ele se destina a ser usado, quão experiente a pessoa que o utiliza precisa ser, quão importante é a informação diagnóstica que ele fornece e como os resultados dos testes podem afetar a saúde de um indivíduo ou a saúde pública. A Referência Técnica TR-006 fornece regras e exemplos detalhados para a classificação de IVDMD. Como os dispositivos médicos são classificados em Hong Kong, em geral? Em Hong Kong, todos os dispositivos médicos são categorizados com base em seu risco associado. Este sistema ajuda a garantir que dispositivos com riscos potenciais mais altos passem por verificações e controles mais rigorosos para proteger a segurança pública. Esta classificação é um passo fundamental no registro de dispositivos médicos em Hong Kong.
As solicitações para adicionar IVDMDs de Classe B, C ou D à Lista de Dispositivos Médicos do MDACS devem sempre ser feitas por uma Pessoa Responsável Local (LRP). Quem pode realmente ser uma Pessoa Responsável Local (LRP)? De nossa experiência, uma LRP pode ser:
Para nosso entendimento, se você é um fabricante estrangeiro sem um negócio registrado em Hong Kong, você deve absolutamente nomear uma LRP para agir em seu nome. Este é um passo crítico para a listagem de IVDMD em Hong Kong.
O processo para listar IVDMDs de Classe B, C e D geralmente segue estas etapas, conforme descrito no GN-06:
Prepare Seus Documentos de Aplicação (Dossiê):
Envie Online via MDIS:
Avaliação da MDD:
Listagem e Certificação:
Ao seguir cuidadosamente os procedimentos descritos no GN-06 e em outras diretrizes relevantes do MDACS, fabricantes e LRPs podem navegar com sucesso pelo processo de listagem de IVDMD em Hong Kong, garantindo que esses dispositivos importantes estejam disponíveis para a saúde pública.
Entraremos em contato pessoalmente.
ElendiLabs
具有“指定值 (Assigned Values)”的校准品和质控品必须与主试剂保持一致,即 Class D,不能降级。 • 附件区分: 只有不具备特定诊断功能的通用耗材(如普通的样本杯或非特异性洗涤液)可以作为 Class A。但在 2026 年的 MDIS 系统申报中,为了确保 Stage C 采购流程的完整性,建议将整个 Test System 作为一个“系统 (System)”进行整体列名,这样可以避免因配件表列号缺失而导致医院收货受阻。
Obtenha orientação passo a passo sobre as regulamentações de dispositivos médicos de Hong Kong, classificação de dispositivos e requisitos de conformidade.
Ver Guia de Dispositivos MédicosEntre em contato conosco em contact@elendilabs.com / +852 4416 5550
Aproximadamente 5 minutos
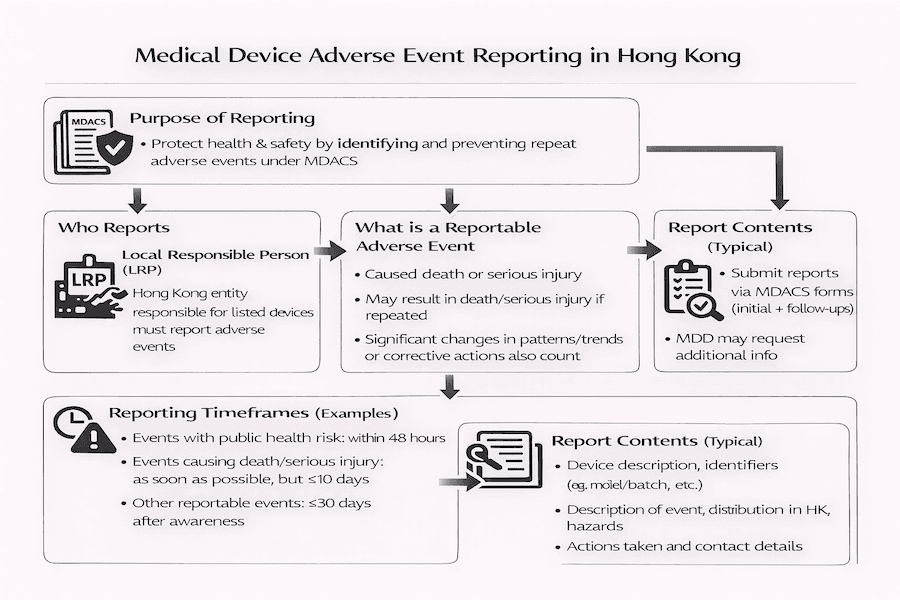
A notificação de eventos adversos é um componente crítico do Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), com o objetivo de melhorar a saúde e a segurança pública. Este artigo descreve os requisitos e responsabilidades das Pessoas Responsáveis Locais (LRPs) na notificação de eventos adversos relacionados a dispositivos médicos listados, com base em nossas percepções.
Aproximadamente 5 minutos
Guia completo sobre regulamentações de dispositivos médicos, classificação, requisitos de registro e vigilância pós-comercialização em Hong Kong.
Aproximadamente 5 minutos
O Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) de Hong Kong fornece uma estrutura robusta, embora atualmente voluntária, para a regulamentação de dispositivos médicos. Este artigo explora as principais características do sistema, incluindo a classificação de dispositivos, o processo de listagem, o papel crucial das Pessoas Responsáveis Locais (LRPs) e sua importância crescente para o acesso ao mercado e a aquisição pública, tudo a partir de nossas percepções e experiências.
Aproximadamente 5 minutos
Este artigo detalha o processo de aplicação para listar Dispositivos Médicos de Diagnóstico In Vitro de Classe B, C e D (IVDMDs) sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme orientado pelo GN-06. Ele abrange classificação, elegibilidade, requisitos de submissão e a aplicação online via MDIS, tudo baseado em nossos insights e experiência para uma listagem eficiente de IVDMD em Hong Kong.
Anonymous
我们计划注册一套高风险传染病检测系统 (Class D)。系统中包含专用校准品、质控品以及通用的洗涤缓冲液。根据 TR-006 Rule 5 和 Rule 7,这些配件必须全部作为 Class D 申报吗?我们能否将通用的洗涤液作为 Class A 附件单独处理,以简化技术文档的更新