Precisa de Ajuda Regulatória? Experimente Nossa Plataforma
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
23 de junho de 2025
Aproximadamente 5 minutos
Classificação de Dispositivos Médicos Gerais em Hong Kong: Um Guia para TR-003
Categorizar a Segurança: Classificação Geral de Dispositivos Médicos em Hong Kong – Nossas Perspectivas
Pelo que observamos, o Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) de Hong Kong utiliza um sistema inteligente para classificar dispositivos médicos com base em seu risco. Tudo isso visa garantir que a quantidade certa de atenção regulatória seja dada a cada dispositivo. Para dispositivos médicos gerais, todas as regras e princípios específicos para classificação estão claramente delineados na Referência Técnica TR-003, que é intitulada "Classificação de Dispositivos Médicos Gerais." Para nossa compreensão, este documento é realmente vital para fabricantes e Pessoas Responsáveis Locais (LRPs), pois afeta diretamente que tipo de "avaliação de conformidade" (provando que seu dispositivo atende aos padrões) você precisará e como todo o seu processo de listagem sob o MDACS ocorrerá. Este é um passo fundamental para classificação de dispositivos médicos em Hong Kong.
De acordo com nossa experiência, os princípios de classificação na TR-003 não são apenas ideias locais; eles correspondem perfeitamente às diretrizes internacionais, especialmente aquelas do Fórum Internacional de Reguladores de Dispositivos Médicos (IMDRF). Isso realmente ajuda a manter as coisas consistentes globalmente quando se trata de regulação de dispositivos médicos em Hong Kong.
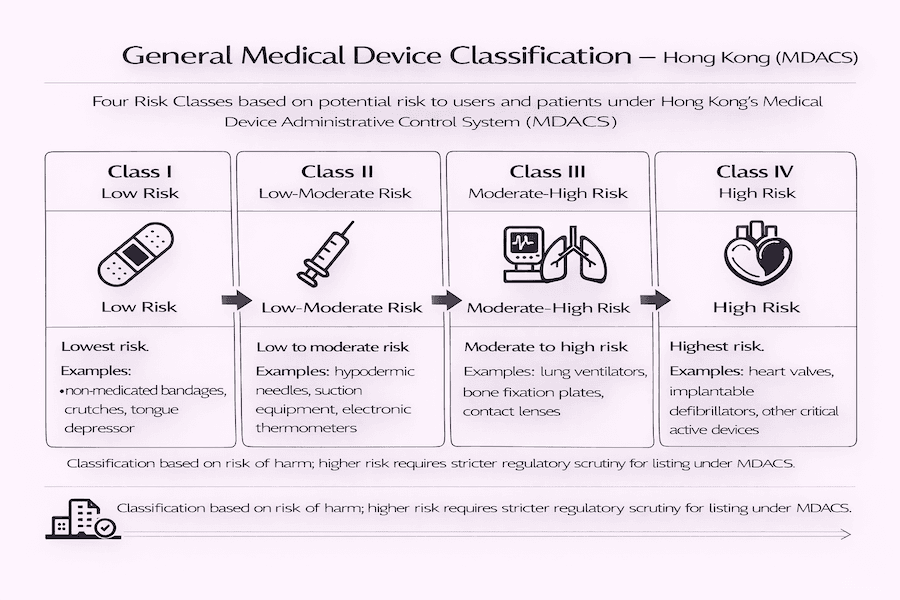
As Quatro Classes de Risco: Quão Arriscado é Seu Dispositivo?
Você já se perguntou como os dispositivos médicos são categorizados? Dispositivos médicos gerais sob o MDACS são colocados em quatro classes diferentes. Essas classes variam do menor risco ao maior, e o que isso significa para você? Quanto maior o risco, mais escrutínio seu dispositivo enfrentará.
- Classe I (低風險): Estes são os dispositivos de menor risco. Pense em itens simples do dia a dia, como bandagens não medicadas, muletas ou um depressor de língua. Para nossa compreensão, estes geralmente não precisam de listagem sob o MDACS.
- Classe II (中低風險): Estes apresentam um risco baixo a moderado. Exemplos comuns que vemos são agulhas hipodérmicas, equipamentos de sucção ou termômetros eletrônicos.
- Classe III (中高風險): Esses dispositivos são considerados de risco moderado a alto. Este grupo inclui coisas como ventiladores pulmonares, placas de fixação óssea ou lentes de contato.
- Classe IV (高風險): Estes são os dispositivos de maior risco. Estamos falando de itens críticos como válvulas cardíacas, desfibriladores implantáveis ou outros dispositivos ativos que vão dentro do corpo.
De acordo com nossa experiência, quanto maior a classe de risco do seu dispositivo, mais rigorosas serão as verificações regulatórias e mais extensas as evidências que você precisará fornecer para a listagem.
Princípios de Classificação: O que Determina a Categoria do Seu Dispositivo?
A TR-003 descreve uma série de regras para classificar dispositivos. Então, o que realmente determina onde seu dispositivo específico se encaixa? Sua classificação depende de um ou vários fatores relacionados ao seu design e ao que se destina a ser usado. Esses fatores podem, sozinhos ou em combinação, afetar a classificação do seu dispositivo:
- Duração do Contato com o Corpo: Por quanto tempo seu dispositivo toca o corpo? É apenas por um momento (transiente), um curto período ou um longo tempo?
- Grau de Invasividade: Seu dispositivo rompe a pele ou entra no corpo? É não invasivo, invasivo (como entrar em uma abertura do corpo ou por meio de cirurgia) ou realmente implantado?
- Entrega de Produtos Medicinais ou Energia: Seu dispositivo entrega medicamento ou energia? E que tipo de entrega é essa?
- Efeito Biológico ou Efeitos Sistêmicos/Locais: Seu dispositivo é destinado a ter um efeito biológico (como interagir com células) ou ser absorvido pelo corpo?
- Uso em Combinação com Outros Dispositivos Médicos: Se seu dispositivo foi projetado para ser usado com outro dispositivo médico, sua classificação pode ser influenciada por como eles funcionam juntos.
- Software Autônomo: Seu software é um dispositivo médico por si só? Se qualificar, sua classificação depende de seu próprio uso pretendido e dos riscos que traz. Software autônomo é geralmente considerado um dispositivo ativo.
Aplicação das Regras de Classificação: Nossa Abordagem Prática
A TR-003 oferece um método passo a passo para aplicar essas regras de classificação. Qual é o nosso conselho para fazer isso de forma eficaz?
- Avaliação Passo a Passo: Sempre orientamos os fabricantes a avaliar cuidadosamente seu dispositivo em relação a cada regra de maneira sistemática.
- Princípio da Classe Mais Alta: E se várias regras se aplicarem? Esta é uma pergunta comum! Se seu dispositivo puder se encaixar em mais de uma categoria, a regra que leva à classificação mais alta (significando o maior risco) é a que você deve usar. De nossa perspectiva, essa abordagem conservadora é projetada para garantir que seu dispositivo seja regulado sob os padrões mais rigorosos possíveis, priorizando a segurança do paciente.
- Exemplos e Explicações: O próprio documento fornece exemplos úteis de dispositivos médicos gerais classificados para mostrar como as regras funcionam na prática. No entanto, é importante lembrar, como sempre enfatizamos, que a classificação final do seu dispositivo específico realmente depende de seu design real, do que você pretende que ele seja usado e de outros fatores únicos. Não confie apenas em exemplos; aprofunde-se nos detalhes do seu produto específico.
Responsabilidade do Fabricante e Papel do LRP: Parceria para o Sucesso
O fabricante é, em última instância, responsável por classificar corretamente seu dispositivo médico de acordo com as regras da TR-003. Incentivamos fortemente que você documente por que atribuiu seu produto a uma classe de risco específica. Essa justificativa pode ser muito útil durante o processo de revisão.
A Pessoa Responsável Local (LRP) em Hong Kong, de nossa experiência, desempenha um papel realmente crucial em ajudar fabricantes estrangeiros com essa classificação. Eles garantem que a aplicação de listagem submetida reflita com precisão a classe de risco correta do dispositivo. Por que a classificação correta é tão fundamental? Porque é a própria base para atender a todos os requisitos subsequentes de avaliação de conformidade e para navegar com sucesso por todo o processo de listagem do MDACS. Para nossa compreensão, a classificação incorreta pode levar a atrasos significativos na aprovação ou até mesmo à não conformidade, o que ninguém deseja!
Ao aplicar diligentemente os princípios e regras da TR-003, os fabricantes contribuem para garantir que os dispositivos médicos colocados no mercado de Hong Kong sejam adequadamente regulados, promovendo a segurança do paciente e a saúde pública.
Pergunte Qualquer Coisa
Entraremos em contato pessoalmente.
Precisa de Orientação Especializada?
Explore Nosso Guia Interativo de Dispositivos Médicos
Obtenha orientação passo a passo sobre as regulamentações de dispositivos médicos de Hong Kong, classificação de dispositivos e requisitos de conformidade.
Ver Guia de Dispositivos MédicosEntre em contato conosco em contact@elendilabs.com / +852 4416 5550
Artigos Relacionados
Aproximadamente 5 minutos
Relato de Eventos Adversos de Dispositivos Médicos em Hong Kong: Um Guia para LRPs
A notificação de eventos adversos é um componente crítico do Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), com o objetivo de melhorar a saúde e a segurança pública. Este artigo descreve os requisitos e responsabilidades das Pessoas Responsáveis Locais (LRPs) na notificação de eventos adversos relacionados a dispositivos médicos listados, com base em nossas percepções.
Aproximadamente 5 minutos
Regulamentações e Registro de Dispositivos Médicos em Hong Kong
Guia completo sobre regulamentações de dispositivos médicos, classificação, requisitos de registro e vigilância pós-comercialização em Hong Kong.
Aproximadamente 5 minutos
Navegando nas Regulamentações de Dispositivos Médicos em Hong Kong: A Estrutura MDACS
O Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) de Hong Kong fornece uma estrutura robusta, embora atualmente voluntária, para a regulamentação de dispositivos médicos. Este artigo explora as principais características do sistema, incluindo a classificação de dispositivos, o processo de listagem, o papel crucial das Pessoas Responsáveis Locais (LRPs) e sua importância crescente para o acesso ao mercado e a aquisição pública, tudo a partir de nossas percepções e experiências.
Aproximadamente 5 minutos
Procedimentos de Listagem para Fabricantes Locais de Dispositivos Médicos em Hong Kong: Um Guia para GN-08
Este artigo detalha o processo de aplicação para fabricantes locais de dispositivos médicos que buscam ser listados sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme orientado pelo GN-08. Ele abrange elegibilidade, requisitos do sistema de gestão da qualidade e o processo de submissão, tudo baseado em nossas percepções e experiências para uma fabricação eficaz de dispositivos médicos em Hong Kong.
Aproximadamente 5 minutos
Procedimentos de Listagem para Importadores de Dispositivos Médicos em Hong Kong: Um Guia para GN-07
Para entidades que importam dispositivos médicos para Hong Kong, o Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) oferece um esquema de listagem voluntária para importadores, orientado pela GN-07. Este artigo detalha a elegibilidade, os passos de aplicação e os principais requisitos para a listagem como importador de dispositivos médicos, com base em nossas percepções e experiências para uma importação eficiente de dispositivos médicos em Hong Kong.
Aproximadamente 5 minutos
Procedimentos de Listagem para Distribuidores de Dispositivos Médicos em Hong Kong: Um Guia para GN-09
Este artigo descreve o processo de aplicação para distribuidores de dispositivos médicos que buscam ser listados sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme detalhado no GN-09. Ele abrange elegibilidade, requisitos-chave para procedimentos documentados e o processo de submissão para aprimorar a rastreabilidade e a segurança pública, com base em nossas percepções.
Aproximadamente 5 minutos
Procedimentos de Listagem para Dispositivos Médicos de Diagnóstico In Vitro de Classe B, C e D em Hong Kong: Um Guia para GN-06
Este artigo detalha o processo de aplicação para listar Dispositivos Médicos de Diagnóstico In Vitro de Classe B, C e D (IVDMDs) sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme orientado pelo GN-06. Ele abrange classificação, elegibilidade, requisitos de submissão e a aplicação online via MDIS, tudo baseado em nossos insights e experiência para uma listagem eficiente de IVDMD em Hong Kong.