Precisa de Ajuda Regulatória? Experimente Nossa Plataforma
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
17 de abril de 2025
Aproximadamente 5 minutos
Princípios Essenciais de Segurança e Desempenho para Dispositivos Médicos em Hong Kong: Compreendendo TR-001 e TR-004
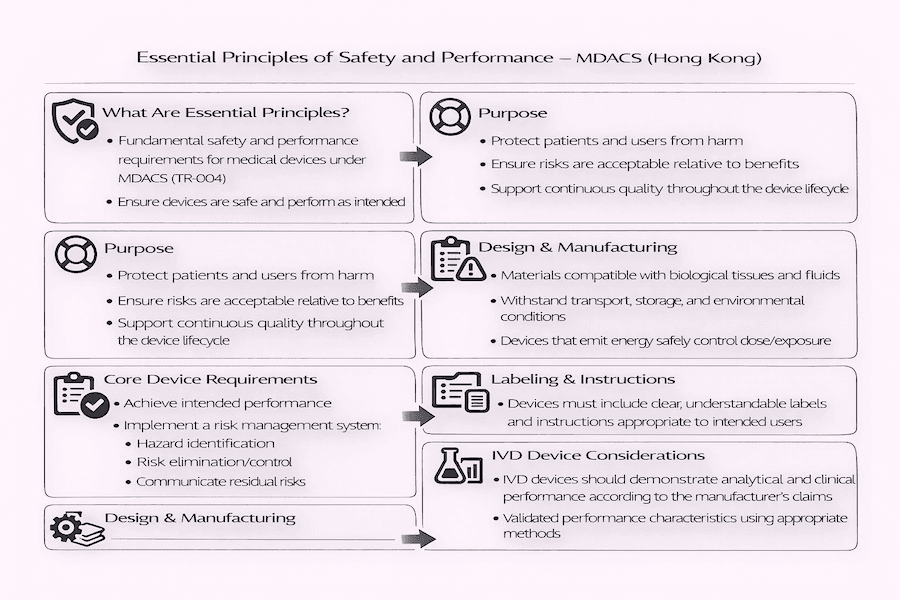
A Pedra Angular da Segurança de Dispositivos Médicos: Princípios Essenciais de Hong Kong – Nossas Perspectivas
Pelo que observamos, garantir a segurança e o desempenho de dispositivos médicos no mercado de Hong Kong é absolutamente primordial. Este compromisso é baseado em um conjunto de requisitos fundamentais conhecidos como Princípios Essenciais de Segurança e Desempenho de Dispositivos Médicos. Esses princípios importantes são principalmente explicados na Referência Técnica TR-004. Ao mesmo tempo, a Referência Técnica TR-001 descreve como os fabricantes podem realmente provar que atendem a esses princípios, delineando as evidências e os procedimentos que precisam seguir.
Para nossa compreensão, esses documentos não são apenas criados do nada. Eles são adaptados diretamente das melhores práticas internacionais, especialmente das recomendações de grupos como o Fórum Internacional de Reguladores de Dispositivos Médicos (IMDRF). Isso garante que os padrões de segurança de dispositivos médicos em Hong Kong estejam alinhados com o que é esperado globalmente.
Objetivo Geral: Segurança e Desempenho Pretendido – Qual é o Grande Objetivo?
Qual é a ideia central por trás de todos esses Princípios Essenciais? Simplificando, seu principal objetivo é garantir que os dispositivos médicos sejam projetados e fabricados de tal forma que, quando usados conforme pretendido e em condições normais, não coloquem pacientes, usuários ou qualquer outra pessoa em risco. Quaisquer riscos que existam devem ser aceitáveis quando comparados aos benefícios que o paciente recebe, e de acordo com nossa experiência, esses riscos devem ser reduzidos tanto quanto razoavelmente possível.
Descobrimos que os fabricantes devem adotar uma abordagem de "gestão de riscos". Isso significa que eles devem priorizar a eliminação ou redução de perigos potenciais desde a fase de design e ao longo do processo de fabricação, tornando os dispositivos intrinsecamente seguros. Isso é crucial para conformidade regulatória em Hong Kong.
Áreas-Chave Abrangidas pelos Princípios Essenciais: Um Olhar Mais Próximo
Os Princípios Essenciais cobrem uma ampla gama de requisitos que podem ser agrupados em várias áreas importantes:
-
Requisitos Gerais: Os Fundamentos para Dispositivos Seguros
- Gestão de Riscos: Os fabricantes devem ter um plano claro para gerenciar riscos. O que isso envolve? Identificar perigos conhecidos ou previsíveis, determinar a magnitude desses riscos e, em seguida, eliminá-los ou controlá-los. Os usuários também devem ser informados sobre quaisquer riscos remanescentes. Isso é central para regulamentação de dispositivos médicos em Hong Kong.
- Relação Benefício-Risco: Os benefícios que o dispositivo proporciona devem sempre superar quaisquer danos potenciais.
- Desempenho e Propósito Pretendido: O dispositivo precisa funcionar exatamente como o fabricante afirma que funcionará, e deve ser adequado para seu uso pretendido em condições normais.
- Desempenho ao Longo da Vida: As características do dispositivo e seu funcionamento não devem piorar durante sua vida útil esperada, conforme declarado pelo fabricante.
- Transporte e Armazenamento: Os dispositivos devem ser projetados, fabricados e embalados de forma a garantir que suas características e desempenho não sejam negativamente afetados durante o transporte e armazenamento.
- Estabilidade: O dispositivo deve permanecer estável e eficaz durante sua vida útil e após ser aberto para uso.
-
Requisitos de Design e Fabricação: Incorporando Segurança
- Propriedades Químicas, Físicas e Biológicas: Os dispositivos devem ser projetados e fabricados com materiais que mantenham os riscos de contaminantes e resíduos ao mínimo. Ser compatível com os tecidos, fluidos e outras substâncias do corpo também é vital.
- Infecção e Contaminação Microbiana: Os processos de design e fabricação devem eliminar ou reduzir significativamente o risco de infecção para pacientes e usuários, especialmente para dispositivos que são fornecidos estéreis.
- Propriedades de Fabricação e Ambientais: Os dispositivos devem ser projetados para uso seguro com quaisquer materiais, substâncias e gases com os quais possam entrar em contato. Os riscos de substâncias vazando ou escapando do dispositivo, ou a entrada/saída indesejada de substâncias, devem ser minimizados.
- Dispositivos com Função de Medição: Dispositivos destinados a medir coisas (como monitores de pressão arterial ou termômetros) devem ser projetados e fabricados para serem precisos, exatos e estáveis o suficiente para o que se propõem a fazer.
- Proteção contra Radiação: Dispositivos que emitem radiação devem ser projetados e fabricados para manter a exposição de pacientes, usuários e outros o mais baixa possível, de acordo com a forma como o dispositivo deve ser usado.
- Proteção contra Choque Elétrico, Riscos Mecânicos e Térmicos: Os dispositivos devem proteger contra perigos de eletricidade, partes móveis e calor.
- Proteção contra Riscos para Pacientes ou Usuários: Isso abrange aspectos como como o dispositivo é alimentado, se possui sistemas de alarme e como previne o uso acidental.
Todos os dispositivos médicos precisam atender a todos esses princípios de design e fabricação? Não necessariamente. Os fabricantes precisam apenas aplicar os Princípios Essenciais que são relevantes para seu dispositivo específico. Por exemplo, um curativo não elétrico não precisaria atender aos requisitos de proteção contra choque elétrico. A chave é aplicar uma abordagem baseada em riscos para determinar a relevância.
-
Informações Fornecidas pelo Fabricante: Comunicação Clara é Fundamental
- Rotulagem e Instruções de Uso (IFU): Informações cruciais devem ser fornecidas diretamente no dispositivo ou em sua embalagem, e em instruções de uso de fácil compreensão. Que tipo de informação? Isso inclui o nome do dispositivo, detalhes do fabricante, seu uso pretendido, quaisquer avisos importantes e instruções claras para uso seguro.
- Identificação Única do Dispositivo (UDI): Onde aplicável (e estamos vendo isso se tornar mais comum globalmente), os dispositivos devem ter um UDI para facilitar seu rastreamento. Isso ajuda com rastreamento de dispositivos médicos em Hong Kong.
Provando a Conformidade: O Papel do TR-001 na Prática
Enquanto o TR-004 fornece a lista de Princípios Essenciais, o TR-001 é onde realmente entramos nos detalhes de como provar que você os atende. Ele descreve as evidências e os procedimentos que os fabricantes usam para mostrar que seus dispositivos médicos são seguros, funcionam conforme o pretendido e estão totalmente em conformidade com esses Princípios Essenciais. Que tipo de evidência estamos falando? Isso inclui detalhes sobre seu sistema de gestão da qualidade (como você gerencia a qualidade), seu sistema de vigilância pós-comercialização (como você monitora o dispositivo após a venda), sua documentação técnica resumida (STED – um resumo conciso de todas as suas informações técnicas) e sua declaração de conformidade (uma declaração formal de que você atende às regras).
De acordo com nossa experiência, quanto maior o risco que um dispositivo representa, mais rigorosa se torna essa "avaliação de conformidade". Isso influencia diretamente a registro de dispositivos médicos em Hong Kong.
Nossa Conclusão Final: Além das Regulamentações
A adesão a esses Princípios Essenciais não se trata apenas de marcar caixas para os reguladores. De nossa perspectiva, é um compromisso fundamental dos fabricantes para garantir a segurança do paciente e confirmar que seu produto realmente funciona como deveria dentro do dinâmico mercado de dispositivos médicos de Hong Kong. E os LRPs? Eles desempenham um papel absolutamente vital em garantir que esses princípios sejam mantidos ao longo de todo o ciclo de vida do dispositivo. Você tem confiança de que seu dispositivo médico atende plenamente a esses princípios essenciais para o mercado de Hong Kong?
Pergunte Qualquer Coisa
Entraremos em contato pessoalmente.
Precisa de Orientação Especializada?
Explore Nosso Guia Interativo de Dispositivos Médicos
Obtenha orientação passo a passo sobre as regulamentações de dispositivos médicos de Hong Kong, classificação de dispositivos e requisitos de conformidade.
Ver Guia de Dispositivos MédicosEntre em contato conosco em contact@elendilabs.com / +852 4416 5550
Artigos Relacionados
Aproximadamente 5 minutos
Relato de Eventos Adversos de Dispositivos Médicos em Hong Kong: Um Guia para LRPs
A notificação de eventos adversos é um componente crítico do Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), com o objetivo de melhorar a saúde e a segurança pública. Este artigo descreve os requisitos e responsabilidades das Pessoas Responsáveis Locais (LRPs) na notificação de eventos adversos relacionados a dispositivos médicos listados, com base em nossas percepções.
Aproximadamente 5 minutos
Regulamentações e Registro de Dispositivos Médicos em Hong Kong
Guia completo sobre regulamentações de dispositivos médicos, classificação, requisitos de registro e vigilância pós-comercialização em Hong Kong.
Aproximadamente 5 minutos
Navegando nas Regulamentações de Dispositivos Médicos em Hong Kong: A Estrutura MDACS
O Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) de Hong Kong fornece uma estrutura robusta, embora atualmente voluntária, para a regulamentação de dispositivos médicos. Este artigo explora as principais características do sistema, incluindo a classificação de dispositivos, o processo de listagem, o papel crucial das Pessoas Responsáveis Locais (LRPs) e sua importância crescente para o acesso ao mercado e a aquisição pública, tudo a partir de nossas percepções e experiências.
Aproximadamente 5 minutos
Procedimentos de Listagem para Fabricantes Locais de Dispositivos Médicos em Hong Kong: Um Guia para GN-08
Este artigo detalha o processo de aplicação para fabricantes locais de dispositivos médicos que buscam ser listados sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme orientado pelo GN-08. Ele abrange elegibilidade, requisitos do sistema de gestão da qualidade e o processo de submissão, tudo baseado em nossas percepções e experiências para uma fabricação eficaz de dispositivos médicos em Hong Kong.
Aproximadamente 5 minutos
Procedimentos de Listagem para Importadores de Dispositivos Médicos em Hong Kong: Um Guia para GN-07
Para entidades que importam dispositivos médicos para Hong Kong, o Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) oferece um esquema de listagem voluntária para importadores, orientado pela GN-07. Este artigo detalha a elegibilidade, os passos de aplicação e os principais requisitos para a listagem como importador de dispositivos médicos, com base em nossas percepções e experiências para uma importação eficiente de dispositivos médicos em Hong Kong.
Aproximadamente 5 minutos
Procedimentos de Listagem para Distribuidores de Dispositivos Médicos em Hong Kong: Um Guia para GN-09
Este artigo descreve o processo de aplicação para distribuidores de dispositivos médicos que buscam ser listados sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme detalhado no GN-09. Ele abrange elegibilidade, requisitos-chave para procedimentos documentados e o processo de submissão para aprimorar a rastreabilidade e a segurança pública, com base em nossas percepções.
Aproximadamente 5 minutos
Procedimentos de Listagem para Dispositivos Médicos de Diagnóstico In Vitro de Classe B, C e D em Hong Kong: Um Guia para GN-06
Este artigo detalha o processo de aplicação para listar Dispositivos Médicos de Diagnóstico In Vitro de Classe B, C e D (IVDMDs) sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme orientado pelo GN-06. Ele abrange classificação, elegibilidade, requisitos de submissão e a aplicação online via MDIS, tudo baseado em nossos insights e experiência para uma listagem eficiente de IVDMD em Hong Kong.