Precisa de Ajuda Regulatória? Experimente Nossa Plataforma
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
16 de junho de 2025
Aproximadamente 5 minutos
Gerenciando Mudanças para Dispositivos Médicos Listados em Hong Kong: Um Guia para GN-10
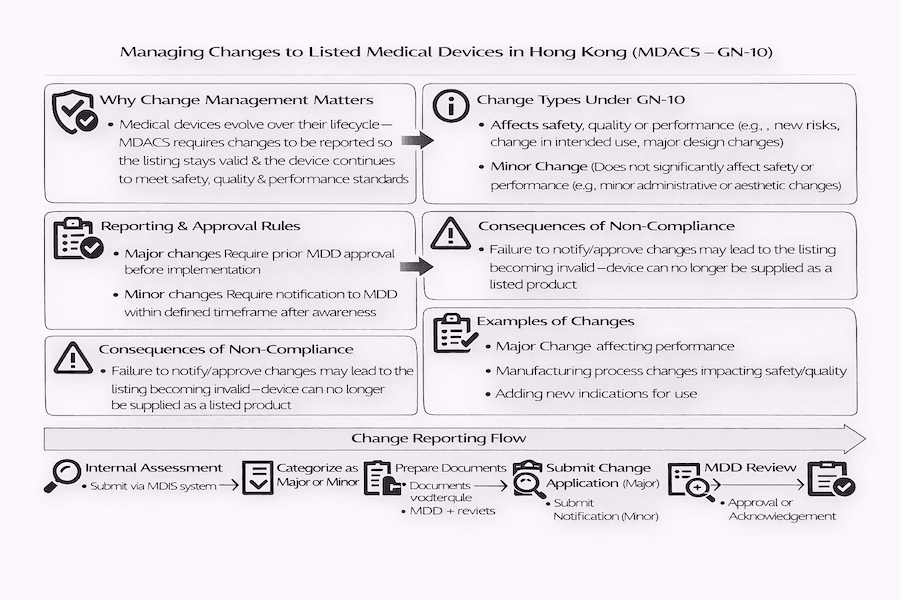
Navegando Mudanças para Dispositivos Médicos Listados em Hong Kong: Nossa Experiência com o GN-10
De nossa perspectiva, apenas conseguir listar um dispositivo médico em Hong Kong não é o fim da jornada. Dispositivos médicos, assim como qualquer outro produto sofisticado, estão sujeitos a evoluir e passar por várias atualizações ao longo de sua vida útil. Sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), é absolutamente crucial que quaisquer mudanças feitas em dispositivos já na lista oficial sejam tratadas corretamente e relatadas. Isso, como entendemos, garante que eles continuem a atender a todas as regras de segurança e desempenho.
As "Notas de Orientação sobre Mudanças para Dispositivos Médicos Listados" (GN-10) atuam como um manual abrangente para Pessoas Responsáveis Locais (LRPs). Ele mostra claramente como identificar, gerenciar e relatar essas mudanças à Divisão de Dispositivos Médicos (MDD) do Departamento de Saúde.
Por que Gerenciar Mudanças é Tão Importante?
A principal razão para o GN-10, como aprendemos, é proteger a saúde pública. Ele garante que as informações sobre dispositivos médicos listados no banco de dados do MDACS permaneçam sempre precisas e atualizadas. Por que isso é importante? Porque qualquer mudança em um dispositivo não deve comprometer sua segurança básica e como ele funciona. Ao relatar mudanças de maneira oportuna, a MDD pode manter registros precisos e verificar quaisquer novos riscos potenciais para pacientes, usuários ou qualquer outra pessoa envolvida. De acordo com nossa experiência, falhar em informar a MDD sobre mudanças dentro dos prazos estabelecidos, ou não obter sua aprovação para grandes mudanças antecipadamente, pode realmente tornar a listagem do dispositivo inválida! Esta é uma consequência séria que sempre aconselhamos os clientes a evitar.
Categorizar Mudanças: É uma Grande Mudança ou um Pequeno Ajuste?
O GN-10 divide as mudanças em dois tipos principais, com base em quanto elas podem afetar a segurança, qualidade ou desempenho de um dispositivo médico (SQP). Como decidimos se uma mudança é 'maior' ou 'menor'?
-
Mudança Maior (需要事先批准的大變動):
- Esta é uma mudança que, de nossa perspectiva, pode impactar diretamente a segurança, qualidade ou desempenho do dispositivo.
- Normalmente, uma mudança maior pode:
- Levar a riscos para o paciente que não havíamos visto antes.
- Aumentar as chances de problemas existentes ocorrerem.
- Mudar como riscos existentes ou novos são apresentados ao usuário (por exemplo, se os rótulos precisam de grandes mudanças, ou se o dispositivo agora é usado para algo novo).
- Quais são alguns exemplos de mudanças maiores que encontramos? Estas frequentemente incluem mudanças no uso do dispositivo, seu design, como é fabricado, como é esterilizado, partes cruciais, ou grandes mudanças em seu software que poderiam afetar a segurança ou desempenho.
- Mudanças maiores precisam absolutamente de aprovação prévia da MDD antes que você possa colocá-las em prática. Este é um passo não negociável.
-
Mudança Menor (只需通知的小調整):
- Esta é uma mudança que, em nossa avaliação, não se encaixa na definição de Mudança Maior.
- Mudanças menores geralmente não têm um grande impacto na segurança, qualidade ou desempenho do dispositivo, e não introduzem novos riscos.
- Quais são algumas mudanças menores comuns que vemos? Estas podem ser atualizações administrativas simples, pequenos ajustes estéticos, ou atualizações em partes que não são críticas para a função principal do dispositivo.
- Para mudanças menores, você geralmente precisa notificar a MDD dentro de um prazo específico (por exemplo, 24 semanas a partir do momento em que a LRP toma conhecimento da mudança), mas geralmente não precisa de sua aprovação antecipadamente.
O GN-10 frequentemente inclui fluxogramas úteis. De acordo com nossa experiência, esses fluxogramas são inestimáveis para LRPs ao tentar descobrir se uma mudança é maior ou menor. Um ponto chave a lembrar: se você estiver fazendo várias mudanças ao mesmo tempo, e mesmo uma delas for considerada uma mudança maior, então todas essas mudanças simultâneas são tratadas como uma Mudança Maior coletiva.
O Papel Crucial da Pessoa Responsável Local (LRP)
A LRP, em nossa visão, desempenha um papel verdadeiramente central na gestão de quaisquer mudanças em dispositivos médicos listados. Suas responsabilidades incluem:
- Avaliação: Verificar cuidadosamente como a mudança pode afetar o paciente, o médico ou enfermeiro que a utiliza, e as especificações gerais do dispositivo.
- Determinação: Usar o GN-10 para decidir se a mudança é uma Mudança Maior ou uma Mudança Menor.
- Notificação/Aplicação: Submeter o formulário correto (uma aplicação para mudanças maiores, ou apenas uma notificação para mudanças menores) à MDD dentro do prazo exigido. Isso geralmente envolve o uso de um Formulário de Aplicação de Mudança específico.
- Documentação: Manter registros muito detalhados de todas as mudanças, por que foram categorizadas dessa forma, e provas de que o dispositivo ainda atende aos seus requisitos básicos de segurança e desempenho.
- Conformidade: Garantir que o dispositivo médico atualizado continue a cumprir todos os "Princípios Essenciais de Segurança e Desempenho."
O Processo de Aplicação/Notificação de Mudanças: O Que Esperar
De nossa experiência, o processo geralmente se desenrola assim:
- Avaliação Interna: A LRP, trabalhando em estreita colaboração com o fabricante, faz uma verificação detalhada da mudança e decide se é uma mudança maior ou menor.
- Preparação de Documentos: Todos os documentos de apoio necessários para a mudança são reunidos, incluindo arquivos técnicos atualizados, análises de risco e relatórios de validação.
- Submissão à MDD:
- Para Mudanças Maiores: Você submete um Formulário de Aplicação de Mudança à MDD para sua pré-aprovação. A MDD irá revisá-lo, e a mudança só pode ser colocada em prática após a aprovação deles.
- Para Mudanças Menores: Você simplesmente notifica a MDD submetendo um Formulário de Aplicação de Mudança dentro do período de notificação estabelecido.
- Revisão e Aprovação/Acknowledgement da MDD: A MDD irá analisar as informações que você submeteu. Para mudanças maiores, eles irão aprová-las ou pedir mais detalhes. Para mudanças menores, eles simplesmente confirmarão que receberam sua notificação.
Mantendo Sua Listagem Válida: Um Lembrete Crítico
É absolutamente essencial que as LRPs sigam rigorosamente as regras do GN-10. Por que isso é tão importante? Porque se uma Mudança Maior for feita sem obter a aprovação da MDD primeiro, ou se quaisquer mudanças não forem relatadas dentro do prazo estabelecido, a listagem do dispositivo médico pode imediatamente se tornar inválida. Pelo que entendemos, em tais casos, o dispositivo não seria mais considerado oficialmente listado sob o MDACS. Isso significa que a LRP teria que parar de vender o dispositivo médico de uma maneira que sugira que ele ainda está listado.
Ao seguir cuidadosamente o GN-10, LRPs e fabricantes garantem que os dispositivos médicos no mercado ativo de Hong Kong permaneçam seguros e atendam a todas as regras necessárias, o que, em última análise, protege os pacientes.
Pergunte Qualquer Coisa
Entraremos em contato pessoalmente.
Precisa de Orientação Especializada?
Explore Nosso Guia Interativo de Dispositivos Médicos
Obtenha orientação passo a passo sobre as regulamentações de dispositivos médicos de Hong Kong, classificação de dispositivos e requisitos de conformidade.
Ver Guia de Dispositivos MédicosEntre em contato conosco em contact@elendilabs.com / +852 4416 5550
Artigos Relacionados
Aproximadamente 5 minutos
Relato de Eventos Adversos de Dispositivos Médicos em Hong Kong: Um Guia para LRPs
A notificação de eventos adversos é um componente crítico do Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), com o objetivo de melhorar a saúde e a segurança pública. Este artigo descreve os requisitos e responsabilidades das Pessoas Responsáveis Locais (LRPs) na notificação de eventos adversos relacionados a dispositivos médicos listados, com base em nossas percepções.
Aproximadamente 5 minutos
Regulamentações e Registro de Dispositivos Médicos em Hong Kong
Guia completo sobre regulamentações de dispositivos médicos, classificação, requisitos de registro e vigilância pós-comercialização em Hong Kong.
Aproximadamente 5 minutos
Navegando nas Regulamentações de Dispositivos Médicos em Hong Kong: A Estrutura MDACS
O Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) de Hong Kong fornece uma estrutura robusta, embora atualmente voluntária, para a regulamentação de dispositivos médicos. Este artigo explora as principais características do sistema, incluindo a classificação de dispositivos, o processo de listagem, o papel crucial das Pessoas Responsáveis Locais (LRPs) e sua importância crescente para o acesso ao mercado e a aquisição pública, tudo a partir de nossas percepções e experiências.
Aproximadamente 5 minutos
Procedimentos de Listagem para Fabricantes Locais de Dispositivos Médicos em Hong Kong: Um Guia para GN-08
Este artigo detalha o processo de aplicação para fabricantes locais de dispositivos médicos que buscam ser listados sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme orientado pelo GN-08. Ele abrange elegibilidade, requisitos do sistema de gestão da qualidade e o processo de submissão, tudo baseado em nossas percepções e experiências para uma fabricação eficaz de dispositivos médicos em Hong Kong.
Aproximadamente 5 minutos
Procedimentos de Listagem para Importadores de Dispositivos Médicos em Hong Kong: Um Guia para GN-07
Para entidades que importam dispositivos médicos para Hong Kong, o Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) oferece um esquema de listagem voluntária para importadores, orientado pela GN-07. Este artigo detalha a elegibilidade, os passos de aplicação e os principais requisitos para a listagem como importador de dispositivos médicos, com base em nossas percepções e experiências para uma importação eficiente de dispositivos médicos em Hong Kong.
Aproximadamente 5 minutos
Procedimentos de Listagem para Distribuidores de Dispositivos Médicos em Hong Kong: Um Guia para GN-09
Este artigo descreve o processo de aplicação para distribuidores de dispositivos médicos que buscam ser listados sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme detalhado no GN-09. Ele abrange elegibilidade, requisitos-chave para procedimentos documentados e o processo de submissão para aprimorar a rastreabilidade e a segurança pública, com base em nossas percepções.
Aproximadamente 5 minutos
Procedimentos de Listagem para Dispositivos Médicos de Diagnóstico In Vitro de Classe B, C e D em Hong Kong: Um Guia para GN-06
Este artigo detalha o processo de aplicação para listar Dispositivos Médicos de Diagnóstico In Vitro de Classe B, C e D (IVDMDs) sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme orientado pelo GN-06. Ele abrange classificação, elegibilidade, requisitos de submissão e a aplicação online via MDIS, tudo baseado em nossos insights e experiência para uma listagem eficiente de IVDMD em Hong Kong.