2025年12月16日
約5分鐘
新加坡 SaMD 監管:網路安全、人工智慧與生命週期合規
新加坡 SaMD 監管:網路安全、人工智慧與生命週期合規
醫療器材軟體 (SaMD),包括獨立軟體、網路應用程式、行動應用程式和人工智慧 (AI) 解決方案,在新加坡受到衛生科學局 (HSA) 的全面監管。HSA 採用生命週期方法,在其《軟體醫療器材監管指南》中概述,涵蓋開發、註冊和上市後義務。
分類與註冊
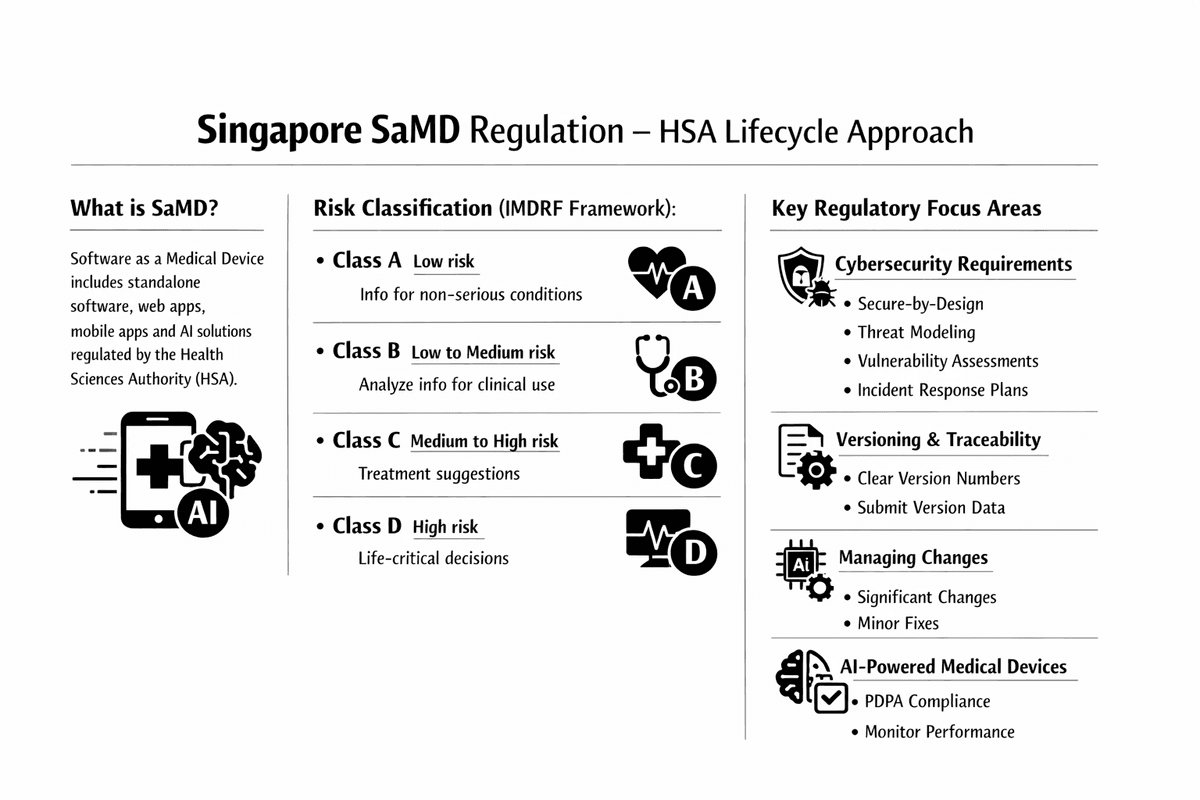
HSA 遵循國際醫療器材監管機構論壇 (IMDRF) 的框架對 SaMD 進行分類,該框架基於軟體提供資訊的重要性和醫療保健情況或條件的狀態。SaMD 被分為四個風險類別(A、B、C、D)。
| SaMD 分類 (IMDRF) | 風險級別 | SaMD 功能範例 |
|---|---|---|
| A 類 | 低風險 | 提供指導臨床管理的資訊,但針對非嚴重情況(例如,患者教育應用程式)。 |
| B 類 | 低到中等風險 | 處理、分析或創建用於非嚴重情況下臨床管理的資訊(例如,基本診斷影像查看)。 |
| C 類 | 中等到高風險 | 處理或分析用於嚴重情況下臨床管理的資訊(例如,建議癌症治療方案的軟體)。 |
| D 類 | 高風險 | 提供用於危急情況或狀態下臨床管理的關鍵資訊(例如,監測患者數據以建議立即生命救援干預的軟體)。 |
所有可註冊的 SaMD 都必須經過標準的產品註冊流程,並遵守所確定的風險類別的要求。
SaMD 的關鍵監管重點領域
1. 網路安全要求
HSA 非常重視 SaMD 生命週期中的網路安全風險管理。註冊檔案必須有文件化的網路安全策略支持,包括:
- 安全設計架構: 從初始開發階段就整合安全措施。
- 威脅建模: 系統地識別和評估潛在的漏洞。
- 漏洞評估: 持續測試以檢測和減輕風險。
- 事件響應計劃: 針對上市後階段的即時威脅檢測和響應的詳細計劃。
2. 版本控制和可追溯性
清晰一致的軟體版本控制對於正確識別和上市後可追溯性是強制性的。SaMD 的標籤要求 (GN-23) 規定:
- 軟體版本號必須清晰顯示(例如,在下載或網路應用程式的啟動畫面或用戶介面上)。
- 版本控制數據必須作為註冊檔案的一部分提交,並且必須反映功能、用戶介面或錯誤修復的變更。
3. 管理變更(變更通知)
對已註冊 SaMD 的任何變更都需要向 HSA 提交變更通知。變更根據其影響進行分類:
- 重大變更: 需要更嚴格的技術審查,包括主要演算法修改、引入新的人工智慧功能或影響可用性或安全的介面重新設計。
- 非重大變更: 通常是行政或輕微的錯誤修復,不影響預期用途或風險概況。
4. 人工智慧驅動的醫療器材 (AI-MD)
基於人工智慧的 SaMD 必須遵守所有醫療器材法規和新加坡特定的數據隱私法(例如,《個人數據保護法》(PDPA))。HSA 的指南 (GL7) 概述了製造商實施自適應或持續學習演算法的原則,強調:
- 解決持續學習模型和模型再培訓的監管影響。
- 確保持續的性能監測和收集真實世界證據。
- 定期向 HSA 報告人工智慧模型的性能。
有任何問題?
我們會親自跟進回覆您。
相關文章
約5分鐘
新加坡醫療器材註冊:HSA 的多途徑依賴體系
新加坡 HSA 透過風險分類(A-D 類)和四種依賴途徑(即時、快速、簡略和完整)監管醫療器材註冊。註冊需要當地**註冊人**,並依賴**參考國家**的批准來簡化流程,將審查時間從 310 天(完整)縮短至即時。
約5分鐘
新加坡體外診斷 (IVD) 器材註冊:HSA 基於風險的依賴途徑
新加坡 HSA 根據 GHTF 風險分類(A-D 類)監管 IVD 器材。註冊利用**參考國家**的批准來確定途徑(即時、快速、簡略或完整),從而顯著減少審查時間,審查時間範圍從 **0 個工作日**(即時)到 **310 個工作日**(D 類完整註冊)。所有申請都必須由當地的**註冊人**提交。
約5分鐘
新加坡醫療器材分類:基於風險的 GHTF 方法
新加坡衛生科學局 (HSA) 遵循 **GHTF 指南**,將醫療器材 (MD) 和 IVD 分為四個風險類別(**A、B、C、D 類**)。風險取決於預期用途、侵入性、接觸時間等因素。風險較高的器材需要更嚴格的註冊。特殊規則適用於**醫療器材軟體 (SaMD)** 以及用於遠程醫療或美容目的的器材。
約5分鐘
新加坡醫療器材註冊分組:HSA 的節省成本途徑
新加坡 HSA 允許醫療器材和 IVD 製造商透過各種分組機制(例如**系列**、**系統**和**組合**)將多個產品整合到單一註冊申請中。前提是這些器材共享預期用途、風險類別和設計等標準。IVD 分析儀、試劑盒和牙科器材有特定的規則。
約5分鐘
新加坡 GDPMDS:醫療器材分銷的強制性品質管理系統
**醫療器材優良分銷規範 (GDPMDS)**,根據 SS 620:2016 正式制定,是新加坡一項強制性的品質管理系統 (QMS) 標準。它由 **HSA** 執行,適用於所有從事醫療器材和 IVD **進口和批發**的公司。GDPMDS 認證是獲得醫療器材經銷商許可證的基礎步驟。
約5分鐘
新加坡醫療器材標籤要求:HSA 合規與 AMDD 協調
新加坡 HSA 強制要求醫療器材和 IVD 標籤使用**英文**,並與 **ASEAN 醫療器材指令 (AMDD)** 保持一致,詳見 **GN-23 指南**。標籤必須包含用於安全識別和使用的資訊,包括產品所有者詳細資訊、批次/批號和滅菌狀態。IVD 還有額外的要求,涵蓋預期用途、性能特徵和樣本類型。
約5分鐘
新加坡醫療器材許可證維護:年費與變更通知
在新加坡維護醫療器材註冊需要每年繳納**年度保留費**,並透過**註冊修改(變更通知)**向 HSA 強制報告所有變更。變更分為行政、審查或技術類,處理時間從 **30 到 90 天**不等,具體取決於器材類別和變更性質。重大的變更,例如預期用途的變更,則需要**新的產品註冊**。
約5分鐘
新加坡上市後監管:強制向 HSA 報告不良事件
新加坡 HSA 根據《衛生產品法》強制要求對所有醫療器材進行上市後監管。當地的**註冊人/分銷商**主要負責報告在新加坡發生的不良事件 (AE),根據嚴重程度,必須在**48 小時內(公共衛生威脅)**至 **30 天內(再次發生可能導致嚴重傷害)**報告。製造商有責任提供所有必要信息,時鐘從收到事件通知後立即開始計時。