ElendiLabs
在香港 MDACS 体系下,“制造商”是指对器械的设计、制造、包装和标签负最终法律责任的实体。如果您的香港总部掌握设计控制权且是 ISO 13485 证书的持有者,您可以尝试申请为“本地制造商”。 • 本土优势: 2026 年 CMPR 框架下,拥有“香港设计、香港监管”身份的产品在公立投标中通常拥有更高的技术评分。即使生产在内地,只要您的 QMS 体系将深圳工厂定义为受控的“外包供应商 (Outsourced Supplier)”,您仍有机会保留本地制造商的法律地位。
2025年6月14日
約5分鐘
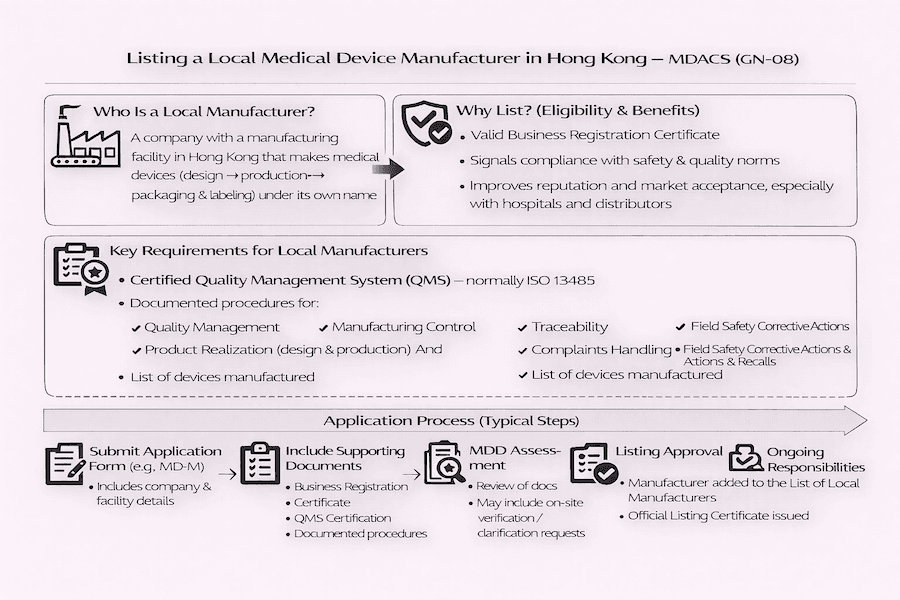
對於在香港生產醫療儀器的製造商而言,醫療儀器行政管理制度 (MDACS) 提供了一項自願上市計劃。這對本地醫療儀器製造意味著什麼呢? 它代表了一條明確的途徑,可以展示您對品質的承諾。針對本地製造商的具體指引詳載於**《醫療儀器本地製造商上市指南》 (GN-08)** 中。據我們理解,這份文件概述了本地製造實體證明其對品質和合規性承諾的標準和程序,從而為該地區醫療儀器的整體安全性和可靠性做出貢獻。
當我們在香港談論「醫療儀器」時,香港衛生署醫療儀器科 (MDD) 究竟認定什麼是醫療儀器呢?根據他們的指引,醫療儀器本質上是任何儀器、器具、機械、電器、植入物、體外診斷試劑或校準器、軟件、材料或其他類似或相關物品。重要的是,製造商預期這些物品是單獨使用或組合使用,為人類達到一個或多個特定的醫療目的。
這些目的包括:
關鍵的是,醫療儀器不會透過藥理、免疫或代謝方式在人體內部或表面實現其主要預期作用,但其預期功能可能會得到這些方式的輔助。因此,它的範圍相當廣泛,從簡單的繃帶到複雜的診斷軟件都涵蓋在內!
根據 MDACS,「本地製造商」是指在香港境內實際從事醫療儀器製造過程的公司或實體。這個製造過程通常涉及哪些環節呢? 從我們的角度來看,它包括了從最初的設計、生產,到醫療儀器以製造商名義投放市場前的包裝和貼標等所有活動。這個定義有助於明確香港醫療儀器製造的相關責任。
任何持有有效商業登記證,並在香港設有生產設施,且生產屬於 MDACS 規範範圍內醫療儀器的法人,都有資格申請列入「本地製造商名單」。雖然上市是自願性質的,但根據我們的經驗,它提供了非常顯著的益處:
要讓您的香港醫療儀器製造業務在 MDACS 下上市,您需要證明符合特定的要求,其中對品質管理體系的重視程度非常高。那麼,最重要的要求是什麼呢?
作為本地醫療儀器製造商上市的申請流程通常包括以下步驟:
從我們的角度來看,獲得上市資格是一項重大成就,但這不是一次性的。 一旦您成功上市,本地製造商就有持續的義務維護其經認證的 QMS,持續遵守其文件化程序,並及時向 MDD 呈報其業務資訊、製造流程或醫療儀器的任何變更。為什麼這種對持續合規的承諾如此重要呢? 因為它確保了在香港製造的醫療儀器的持續安全、品質和功效,最終保障了公共衛生。
我們會親自跟進回覆您。
ElendiLabs
在香港 MDACS 体系下,“制造商”是指对器械的设计、制造、包装和标签负最终法律责任的实体。如果您的香港总部掌握设计控制权且是 ISO 13485 证书的持有者,您可以尝试申请为“本地制造商”。 • 本土优势: 2026 年 CMPR 框架下,拥有“香港设计、香港监管”身份的产品在公立投标中通常拥有更高的技术评分。即使生产在内地,只要您的 QMS 体系将深圳工厂定义为受控的“外包供应商 (Outsourced Supplier)”,您仍有机会保留本地制造商的法律地位。
Anonymous
目前 MDACS 的本地制造商表列主要是‘文件审核制’。但听说 2026 年底 CMPR 成立后会引入现场检查 (On-site Inspection)。对于我们这种租用小型无尘车间的本地企业,如果仓库空间不足或温控记录不全,会被直接撤销 HKMD 编号吗?LRP 在此类审计中承担什么法律责任?
ElendiLabs
是的,2026 年是香港监管从“被动接收”转向“主动飞行检查”的转折点。CMPR 审计将聚焦于追溯性 (Traceability) 和不良事件处理。 • 责任绑定: LRP 需要确保本地工厂的 SOP 符合 COP-01 守则。如果现场审计不合格,CMPR 有权吊销该制造商的所有相关产品列名。
Anonymous
我们是一家位于香港科学园的初创企业,生产一款 II 类物理治疗仪。目前我们的工厂表列申请仍处于‘补充资料’阶段。考虑到 2026 年 3 月 23 日 后,所有公立医院采购 (Stage C3) 必须持有最终的 HKMD 编号(不再接受 Stage B 的申请编号),如果我们在截止日期前未能拿到证书,是否意味着我们必须停供现有的医管局 (HA) 订单?有没有针对‘本地创新器械’的特殊加急通道?
ElendiLabs
2026 年 1 月的最新指引确认 Stage C 没有缓冲期。没有 HKMD 编号,产品将无法在 3 月 23 日后的标书中通过合规审查。 • 加急路径: 卫生署医疗器械分部 (MDD) 虽然没有官方的“加急费”政策,但对于在香港本地生产、且属于政府重点支持的创新器械(如入选 GBA 港澳药械通或科学园项目),LRP 可以向 MDD 提交 “采购紧急证明书 (Urgency Letter for Procurement)”,请求加速技术审评。ElendiLabs 建议您立即在 MDIS 门户 完善所有实验数据,以确保在最后 12 周内获批。
約5分鐘
不良事件呈報是香港醫療儀器行政管理制度 (MDACS) 的關鍵組成部分,旨在加強公共衛生和安全。本文根據我們的見解,概述了本地負責人 (LRP) 在呈報已上市醫療儀器相關不良事件方面的要求和職責。
約5分鐘
香港醫療器械法規、分類、註冊要求和上市後監督的完整指南。包括 MDACS 系統、質量管理和國際協調要求。
約5分鐘
香港的醫療儀器行政管理制度 (MDACS) 為醫療儀器規管提供了一個健全但目前屬自願性質的框架。本文將深入探討該制度的主要特點,包括儀器分類、上市程序、本地負責人 (LRP) 的關鍵作用,以及其對市場准入和公共採購日益增長的重要性,所有這些都來自我們的見解和經驗。
約5分鐘
本文詳細闡述了香港醫療儀器本地製造商根據醫療儀器行政管理制度 (MDACS) (依循 GN-08 指引) 申請上市的程序。內容涵蓋申請資格、質量管理體系要求以及提交流程,所有這些都基於我們對高效香港醫療儀器製造的見解和經驗。
Anonymous
我们的研发和质量控制总部在香港,但实际组装位于深圳的关联工厂。根据 GN-01 指南,我们是否可以申请‘本地制造商 (Local Manufacturer)’身份以获得香港政府采购的本土优先权?还是由于生产基地在内地,必须作为‘海外制造商’并通过‘表列进口商’模式进行注册?